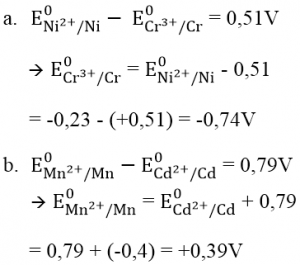Lý thuyết Dòng điện trong chân không hay, chi tiết nhất Bài viết Lý thuyết Dòng điện trong chân không với giải pháp giải cụ thể giúp học viên ôn...
Lý thuyết sự ăn mòn kim loại: Ăn mòn hóa học và ăn mòn điện hóa
I – KHÁI NIỆM
Sự ăn mòn kim loại là sự phá hủy kim loại hoặc kim loại tổng hợp do công dụng của những chất trong môi trường tự nhiên xung quanh .
- Hệ quả: Kim loại bị oxi hoá thành ion dương
M → Mn + + ne
II – CÁC DẠNG ĂN MÒN KIM LOẠI
Có 2 dạng ăn mòn kim loại là ăn mòn hóa học và ăn mòn điện hóa học
1. Ăn mòn hoá học
VD – Thanh sắt trong nhà máy sản xuất sản xuất khí Cl2 Fe + Cl2 → FeCl3⇒ Ăn mòn hóa học là quá trình oxi hóa – khử, trong đó những electron của kim loại được chuyển trực tiếp đến những chất trong môi trường tự nhiên .
2. Ăn mòn điện hoá học
a. Khái niệm về ăn mòn điện hóa
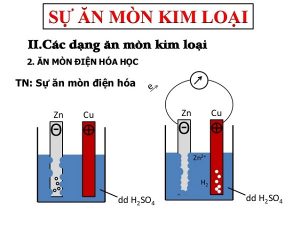
- Hiện tượng:
– Kim điện kế quay ⇒ chứng tỏ có dòng điện chạy qua .– Thanh Zn bị mòn dần .– Bọt khí H2 thoát ra cả ở thanh Cu .
- Giải thích:
– Điện cực âm ( anot ) ; Zn bị ăn mòn theo phản ứng : Zn → Zn2 + + 2 eIon Zn2 + đi vào dung dịch, những electron theo dây dẫn sang điện cực Cu .– Điện cực dương ( catot ) : ion H + của dung dịch H2SO4 nhận electron biến thành nguyên tử H rồi thành phân tử H2 thoát ra. : 2H + + 2 e → H2 ↑⇒ Ăn mòn điện hóa là quá trình oxi hóa – khử, trong đó kim loại bị ăn mòn do công dụng của dung dịch chất điện li và tạo nên dòng electron chuyển dời từ cực âm đến cực dương .
b. Ăn mòn điện hoá học hợp kim sắt trong không khí ẩm
VD : Sự ăn mòn gang trong không khí ẩm .
– Trong không khí ẩm, trên bề mặt của gang luôn có một lớp nước rất mỏng đã hoà tan O2 và khí CO2, tạo thành dung dịch chất điện li.
– Gang có thành phần chính là Fe và C cùng tiếp xúc với dung dịch đó tạo nên vô số những pin nhỏ mà sắt là anot và cacbon là catot .Tại anot : Fe → Fe2 + + 2 eCác electron được giải phóng chuyển dời đến catot .Tại catot : O2 + 2H2 O + 4 e → 4OH -Ion Fe2 + tan vào dung dịch chất điện li có hòa tan khí O2. Tại đây, ion Fe2 + liên tục bị oxi hóa, dưới công dụng của ion OH − tạo ra gỉ sắt có thành phần đa phần là Fe2O3. nH2O .
c. Điều kiện xảy ra sự ăm mòn điện hoá học
- Các điện cực phải khác nhau về bản chất.
Cặp KL – KL ; KL – PK ; KL – Hợp chất hóa học
- Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp qua dây dẫn.
- Các điện cực cùng tiếp xúc với một dung dịch chất điện li.
III, Các phương pháp chống ăn mòn kim loại
1, Phương pháp bảo vệ mặt phẳng : sơn ; mạ kim loại2, Phương pháp điện hóa3, Sản xuất vật tư không bị ăn mòn : kim loại tổng hợp không bị ăn mòn
Bài tập pin điện hóa có lời giải
Bài 1 : Tính thế điện cực chuẩn E0 của những cặp oxi hóa khử sau :a. E0 ( Cr3 + / Cr ), biết suất điện động chuẩn của pin điện hóa Cr – Ni là + 0,51 V và E0 ( Ni2 + / Ni ) = – 0,23 V .b. E0 ( Mn2 + / Mn ), biết suất điện động chuẩn của pin điện hóa Cd – Mn là + 0,79 V và E0 ( Cd2 + / Cd ) = – 0,40 V .
Hướng dẫn
Xem thêm:
Lý thuyết kim loại: điều chế kim loại
Source: https://vh2.com.vn
Category : Điện Tử