Địa chỉ mua và tương hỗ tư vấn không lấy phí về tấm pin năng lượng mặt trời chính hãng2. Lưu ý trong quy trình luân chuyển và cất giữMột...
Năng lượng kích hoạt hóa học Những gì nó bao gồm, tính toán / Hóa học
Năng lượng kích hoạt hóa học Những gì nó bao gồm, tính toán
các năng lượng kích hoạt hóa học (theo quan điểm của các nghiên cứu động học) đề cập đến lượng năng lượng ít nhất có thể cần thiết để bắt đầu một phản ứng hóa học. Theo lý thuyết về sự va chạm trong động học hóa học, người ta nói rằng tất cả các phân tử đang chuyển động đều có một lượng động năng nhất định.
Điều này có nghĩa là vận tốc hoạt động của bạn càng lớn thì cường độ động năng của bạn càng lớn. Theo nghĩa này, một phân tử mang hoạt động nhanh không hề tự chia thành những mảnh, do đó phải xảy ra va chạm giữa nó và một phân tử khác để hoàn toàn có thể xảy ra phản ứng hóa học .
Khi điều này xảy ra – khi xảy ra va chạm giữa những phân tử – một phần động năng của nó được chuyển thành năng lượng rung động. Tương tự như vậy, nếu ở đầu quy trình, động năng cao, những phân tử tham gia vào vụ va chạm sẽ tạo ra sự rung động lớn đến mức một số ít link hóa học xuất hiện sẽ bị phá vỡ ..Sự phá vỡ link này là bước tiên phong trong việc quy đổi chất phản ứng thành loại sản phẩm ; đó là, trong sự hình thành của những. Mặt khác, nếu mở màn quy trình này, động năng có cường độ nhỏ, sẽ có hiện tượng kỳ lạ ” bật lại ” những phân tử, qua đó chúng sẽ tách rời thực tiễn nguyên vẹn ..Chỉ số
- 1 Nó bao gồm những gì??
- 1.1 Kích hoạt phức tạp
- 2 Nó được tính như thế nào?
- 2.1 Tính toán năng lượng kích hoạt của phản ứng hóa học
- 3 Năng lượng kích hoạt ảnh hưởng đến tốc độ của phản ứng như thế nào?
- 4 Ví dụ về tính toán năng lượng kích hoạt
- 5 tài liệu tham khảo
Nó bao gồm những gì??
Bắt đầu từ khái niệm va chạm giữa những phân tử để khởi đầu những phản ứng hóa học được diễn đạt trước đây, hoàn toàn có thể nói rằng có một lượng năng lượng tối thiểu thiết yếu cho một vụ va chạm xảy ra .Vì vậy, nếu giá trị năng lượng nhỏ hơn mức tối thiểu thiết yếu này, đơn thuần là sẽ không có sự đổi khác giữa những phân tử sau khi va chạm xảy ra, điều đó có nghĩa là khi năng lượng này vắng mặt, những loài tương quan vẫn gần như nguyên vẹn và sẽ không xảy ra bất kể đổi khác nào do cú sốc này .Theo thứ tự những sáng tạo độc đáo này, năng lượng tối thiểu thiết yếu cho một sự biến hóa xảy ra sau khi va chạm giữa những phân tử được gọi là năng lượng kích hoạt .Nói cách khác, những phân tử tương quan đến một cú sốc phải có một lượng tổng động năng với cường độ bằng hoặc lớn hơn năng lượng kích hoạt để hoàn toàn có thể xảy ra phản ứng hóa học. Ngoài ra, trong nhiều trường hợp, những phân tử va chạm và tạo ra một loài mới gọi là phức tạp kích hoạt, cấu trúc còn được gọi là ” trạng thái chuyển tiếp ” chính bới nó chỉ sống sót trong thời điểm tạm thời .Nó được gây ra bởi những loài phản ứng do sự va chạm và trước khi hình thành những mẫu sản phẩm của phản ứng .
Kích hoạt phức tạp
Phức hợp kích hoạt được đề cập ở trên tạo thành một loài có độ không thay đổi rất thấp, nhưng đến lượt nó lại có một lượng lớn năng lượng tiềm năng .Sơ đồ sau đây cho thấy sự biến hóa chất phản ứng thành loại sản phẩm, được biểu lộ dưới dạng năng lượng và quan tâm rằng cường độ năng lượng của phức chất được kích hoạt được hình thành lớn hơn đáng kể so với chất phản ứng và loại sản phẩm ..
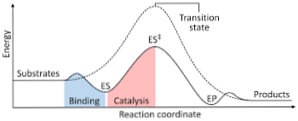
Nếu ở cuối phản ứng, những loại sản phẩm có độ không thay đổi cao hơn những chất phản ứng, sự giải phóng năng lượng xảy ra dưới dạng nhiệt, tạo ra phản ứng tỏa nhiệt ..trái lại, nếu những chất phản ứng dẫn đến độ không thay đổi lớn hơn những loại sản phẩm, điều đó có nghĩa là hỗn hợp phản ứng bộc lộ sự hấp thụ năng lượng dưới dạng nhiệt từ thiên nhiên và môi trường xung quanh, dẫn đến phản ứng nhiệt ..Tương tự, nếu trường hợp này hay trường hợp khác xảy ra, một sơ đồ phải được thiết kế xây dựng, ví dụ điển hình như trường hợp được hiển thị trước đó, trong đó năng lượng tiềm năng của mạng lưới hệ thống phản ứng chống lại tiến trình hoặc tiến trình của phản ứng được vẽ ..Theo cách này, những đổi khác năng lượng tiềm năng xảy ra khi phản ứng xảy ra và những chất phản ứng được chuyển thành những loại sản phẩm .
Nó được tính như thế nào?
Năng lượng kích hoạt của phản ứng hóa học có tương quan mật thiết đến hằng số tốc độ của phản ứng đó và sự phụ thuộc vào của hằng số này vào nhiệt độ được bộc lộ bằng phương trình Arrhenius :k = Ae-Ea / RTTrong biểu thức này k đại diện thay mặt cho hằng số vận tốc của phản ứng ( nhờ vào vào nhiệt độ ) và tham số Một nó được gọi là thông số tần số và nó là thước đo tần số của những va chạm giữa những phân tử .Về phần mình, e miêu tả cơ sở của chuỗi logarit tự nhiên. Nó được nâng lên thành một hiệu suất bằng thương số âm của năng lượng kích hoạt ( Ea ) giữa mẫu sản phẩm tạo ra từ hằng số khí ( R ) và nhiệt độ tuyệt đối ( T ) của mạng lưới hệ thống để xem xét .Cần chú ý quan tâm rằng yếu tố tần số hoàn toàn có thể được coi là một hằng số trong những mạng lưới hệ thống phản ứng nhất định trong một khoanh vùng phạm vi nhiệt độ rộng .
Biểu thức toán học này ban đầu được cho là bởi nhà hóa học người Hà Lan Jacobus Henricus van’t Hoff vào năm 1884, nhưng người đã cho nó giá trị khoa học và giải thích tiền đề của nó là nhà hóa học gốc Thụy Điển Svante Arrhenius, vào năm 1889.
Tính năng lượng hoạt hóa của phản ứng hóa học
Phương trình Arrhenius chỉ ra tỷ suất thuận trực tiếp sống sót giữa hằng số tốc độ của phản ứng và tần số va chạm giữa những phân tử .Ngoài ra, phương trình này hoàn toàn có thể được màn biểu diễn theo cách thuận tiện hơn bằng cách vận dụng đặc thù của logarit tự nhiên cho mỗi bên của phương trình, thu được :ln k = ln A – Ea / RTKhi sắp xếp lại những pháp luật để có được phương trình của một dòng ( y = mx + b ), biểu thức sau đây đạt được :ln k = ( – Ea / R ) ( 1 / T ) + ln AVì vậy, khi thiết kế xây dựng đồ thị ln k so với 1 / T, tất cả chúng ta có được một đường thẳng, trong đó ln k đại diện thay mặt cho tọa độ y, ( – A / R ) đại diện thay mặt cho độ dốc của đường ( m ), ( 1 / T ) đại diện thay mặt cho tọa độ x và ln A đại diện thay mặt cho giao điểm với trục của tọa độ ( b ). Có thể thấy, độ dốc hiệu quả từ phép tính này bằng với giá trị của – Ea / R. Điều này ý niệm rằng, nếu muốn đạt được giá trị của năng lượng kích hoạt bằng biểu thức này, thì cần thực thi một thao tác xóa đơn thuần, dẫn đến :Ea = – mRỞ đây tất cả chúng ta biết giá trị của m và R là hằng số bằng 8,14 J / K · mol .
Năng lượng kích hoạt ảnh hưởng đến tốc độ của phản ứng như thế nào?
Khi nỗ lực tạo ra hình ảnh của năng lượng kích hoạt, nó hoàn toàn có thể được coi là một rào cản không được cho phép phản ứng xảy ra giữa những phân tử năng lượng thấp hơn .Như trong một phản ứng thường thì xảy ra, số lượng phân tử hoàn toàn có thể phản ứng là khá lớn, vận tốc – và tương tự, động năng của những phân tử này – hoàn toàn có thể rất khác nhau .Nó thường xảy ra rằng chỉ một lượng nhỏ trong tổng số những phân tử gặp phải va chạm – những phân tử có vận tốc vận động và di chuyển lớn hơn – bộc lộ đủ động năng để hoàn toàn có thể vượt qua cường độ của năng lượng kích hoạt. Vì vậy, những phân tử này là apt và hoàn toàn có thể là một phần của phản ứng .Theo phương trình Arrhenius, dấu âm – đi trước thương số giữa năng lượng kích hoạt và tích của hằng số khí theo nhiệt độ tuyệt đối – ý niệm rằng hằng số tốc độ giảm khi có sự ngày càng tăng năng lượng kích hoạt, cũng như sự tăng trưởng khi nhiệt độ tăng .
Ví dụ về tính toán năng lượng kích hoạt
Để tính năng lượng kích hoạt bằng cách thiết kế xây dựng một biểu đồ, theo phương trình Arrhenius, tất cả chúng ta có những hằng số vận tốc cho phản ứng phân hủy acetaldehyd đã được đo ở năm nhiệt độ khác nhau và chúng tôi muốn xác lập năng lượng kích hoạt cho phản ứng, được bộc lộ như sau :CH3CHO ( g ) → CH4 ( g ) + CO ( g )Dữ liệu của năm phép đo như sau :k ( 1 / M1 / 2 · S ) : 0,011 – 0,035 – 0,105 – 0,343 – 0,789T ( K ) : 700 – 730 – 760 – 790 – 810Trước tiên, để xử lý điều chưa biết này và xác lập năng lượng kích hoạt, tất cả chúng ta phải kiến thiết xây dựng một biểu đồ ln k vs 1 / T ( y vs x ), để có được một đường thẳng và từ đây đi theo độ dốc và tìm giá trị của Ea, như đã lý giải. Chuyển đổi tài liệu của những phép đo, theo phương trình Arrhenius [ ln k = ( – Ea / R ) ( 1 / T ) + ln A ], những giá trị sau được tìm thấy cho y và x, tương ứng :ln k : ( – 4,51 ) – ( – 3,35 ) – ( – 2.254 ) – ( – 1.070 ) – ( – 0.237 )1 / T ( K-1 ) : 1,43 * 10-3 – 1,37 * 10-3 – 1,32 * 10-3 – 1,27 * 10-3 – 1,23 * 10-3
Trong số các giá trị này và bằng phương pháp tính toán toán học về độ dốc – trong máy tính hoặc trong máy tính, bằng biểu thức m = (Y2-Y1) / (X2-X1) hoặc sử dụng phương pháp hồi quy tuyến tính – chúng tôi thu được m = -Ea / R = -2,09 * 104 K. Vậy:
Ea = ( 8.314 J / K · mol ) ( 2.09 * 104 K )= 1,74 * 105 = 1,74 * 102 kJ / molĐể xác lập những năng lượng kích hoạt khác trải qua cách đồ họa, một tiến trình tương tự như được triển khai .
Tài liệu tham khảo
- Wikipedia. (s.f.). Năng lượng kích hoạt. Lấy từ en.wikipedia.org
- Chang, R. (2007). Hóa học, phiên bản thứ chín. Mexico: Đồi McGraw.
- Britannica, E. (s.f.). Năng lượng kích hoạt. Lấy từ britannica.com
- Moore, J. W. và Pearson, R. G. (1961). Động học và cơ chế. Lấy từ sách.google.com.vn
- Kaesche, H. (2003). Ăn mòn kim loại: Nguyên tắc hóa lý và các vấn đề hiện tại. Lấy từ sách.google.com.vn
Source: https://vh2.com.vn
Category : Năng Lượng



