Có thể nói rằng sau khi các trang mạng xã hội có hoạt động livestream được rất nhiều người sử dung. Nó dường như đóng một vai trò đặc biệt...
Quyết định 1314/QĐ-BYT Hướng dẫn chẩn đoán, điều trị và dự phòng bệnh lao
Xét Biên bản họp Hội đồng tài liệu cập nhật, điều chỉnh Hướng dẫn chẩn đoán, điều trị và dự phòng bệnh lao ngày 20 tháng 12 năm 2019;
Điều 1. Ban hành kèm theo Quyết định này “Hướng dẫn chẩn đoán, điều trị và dự phòng bệnh lao”.
Điều 2. “Hướng dẫn chẩn đoán, điều trị và dự phòng bệnh lao” áp dụng cho tất cả các cơ sở khám bệnh, chữa bệnh Nhà nước và tư nhân trên cả nước.
Điều 3. Quyết định này có hiệu lực kể từ ngày ký, ban hành và thay thế Quyết định số 3126/QĐ-BYT ngày 23 tháng 5 năm 2018 của Bộ trưởng Bộ Y tế về việc ban hành Hướng dẫn chẩn đoán, điều trị và dự phòng bệnh lao.
Điều 4. Các Ông / Bà : Chánh Văn phòng Bộ, Cục trưởng Cục Quản lý Khám, chữa bệnh – Bộ Y tế ; Chánh Thanh tra – Bộ Y tế ; Tổng Cục trưởng, Cục trưởng, Vụ trưởng những Tổng Cục, Cục, Vụ thuộc Bộ Y tế ; Giám đốc những Bệnh viện, Viện có giường bệnh thường trực Bộ Y tế ; Giám đốc Sở Y tế những tỉnh, thành phố thường trực TW ; Thủ trưởng y tế những ngành chịu nghĩa vụ và trách nhiệm thi hành Quyết định này .Nơi nhận : – Như điều 4 ; – Bộ trưởng ( để báo cáo giải trình ) ; – Các Thứ trưởng ( để phối hợp chỉ huy ) ; – Bảo hiểm Xã hội Nước Ta ( để phối hợp ) ; – Cục Quân y Bộ Quốc phòng ; Cục Y tế Bộ Công an ; – BV lao và BPhổi, TTPCCBXH, TTYTDP những tỉnh, CDC thành phố thường trực TW ; – Cổng TTĐT Bộ Y tế ; website Cục QLKCB ; – Lưu : VT ; KCB ; PCXpert MTB / RIF : Xét nghiệm ứng dụng công nghệ sinh học phân tử để nhận diện vi trùng lao kể cả vi trùng lao kháng Rifampicin4. Xử trí một số ít công dụng không mong ước do thuốc lao3. Một số tính năng không mong ước thường gặp với thuốc chống lao và hướng xử trí2. Phân loại mức độ công dụng không mong ước của thuốc laoPHÁT HIỆN XỬ TRÍ TÁC DỤNG KHÔNG MONG MUỐN CỦA THUÔC CHỐNG LAO4. Điều trị lao cho những trường hợp đặc biệt quan trọng3. Chỉ định và phác đồ điều trị4. Mô tả và nghiên cứu và phân tích hình ảnh Xquang của lao phổi trên phim phổi thường quyCHẨN ĐOÁN ĐIỀU TRỊ VÀ DỰ PHÒNG BỆNH LAO ( Ban hành kèm theo Quyết định số : 1314 / QĐ-BYT ngày 24 tháng 3 năm 2020 của Bộ trưởng Bộ Y tế )
CHẨN ĐOÁN BỆNH LAO
Lao là một bệnh truyền nhiễm do vi trùng lao ( Mycobacterium tuberculosis ) gây nên. Bệnh lao hoàn toàn có thể gặp ở tổng thể những bộ phận của khung hình, trong đó lao phổi là thể lao phổ cập nhất ( chiếm 80 – 85 % tổng số ca bệnh ) và là nguồn lây chính cho người xung quanh .
1. NGƯỜI NGHI LAO PHỔI
1.1. Người nghi lao phổi khi có các triệu chứng sau:
– Ho lê dài trên 2 tuần ( ho khan, ho có đờm, ho ra máu ) là triệu chứng nghi lao quan trọng nhất .
Ngoài ra hoàn toàn có thể :
– Gầy sút, kém ăn, stress .
– Sốt nhẹ về chiều .
– Ra mồ hôi “ trộm ” đêm hôm .
– Đau ngực, đôi lúc khó thở .
1.2. Nhóm nguy cơ cao cần chú ý
– Người nhiễm HIV .
– Người tiếp xúc trực tiếp với nguồn lây, đặc biệt quan trọng trẻ nhỏ .
– Người mắc những bệnh mạn tính : loét dạ dày-tá tràng, đái tháo đường, suy thận mạn, …
– Người nghiện ma túy, rượu, thuốc lá, thuốc lào .
– Người sử dụng những thuốc ức chế miễn dịch lê dài như corticoid, hóa chất điều trị ung thư, …
1.3. Các trường hợp có bất thường trên X-quang phổi đều cần xem xét phát hiện lao phổi.
2. CHẨN ĐOÁN LAO PHỔI
2.1. Dựa vào lâm sàng
– Toàn thân : sốt nhẹ về chiều, ra mồ hôi đêm, chán ăn, căng thẳng mệt mỏi, gầy sút cân .
– Cơ năng : ho, khạc đờm, ho ra máu, đau ngực, khó thở .
– Thực thể : nghe phổi hoàn toàn có thể có tiếng bệnh lý ( ran ẩm, ran nổ, …. ) .
2.2. Dựa vào cận lâm sàng
– Nhuộm soi đờm trực tiếp tìm AFB : tổng thể những người có triệu chứng nghi lao phải được xét nghiệm đờm phát hiện lao phổi. Để thuận tiện cho người bệnh hoàn toàn có thể chẩn đoán được trong ngày đến khám bệnh, xét nghiệm 2 mẫu đờm tại chỗ cần được vận dụng thay cho xét nghiệm 3 mẫu đờm như trước đây. Mẫu đờm tại chỗ cần được hướng dẫn cẩn trọng để người bệnh lấy đúng cách ( Phụ lục 1 ), thời gian lấy mẫu 1 và mẫu 2 phải cách nhau tối thiểu là 2 giờ .
– Xét nghiệm Xpert MTB / RIF để chẩn đoán bệnh lao và lao kháng Rifampicin cho tác dụng sau khoảng chừng 2 giờ với độ nhạy và độ đặc hiệu cao. Các trường hợp AFB ( + ) cần được làm xét nghiệm Xpert để biết thực trạng kháng thuốc Rifampicin trước khi cho phác đồ thuốc chống lao hàng 1 .
– Nuôi cấy tìm vi trùng lao : nuôi cấy trên thiên nhiên và môi trường đặc thường cho tác dụng dương thế sau 3-4 tuần. Nuôi cấy trong thiên nhiên và môi trường lỏng ( MGIT – BACTEC ) cho tác dụng dương thế sau 2 tuần. Các trường hợp phát hiện tại những bệnh viện tuyến tỉnh nên được khuyến khích xét nghiệm nuôi cấy khi có điều kiện kèm theo .
– Xquang phổi thường quy : hình ảnh trên phim X-quang gợi ý lao phổi tiến triển là thâm nhiễm, nốt, hang, hoàn toàn có thể 1 bên hoặc 2 bên. Ở người có HIV, hình ảnh X-quang phổi ít thấy hình hang, hay gặp tổn thương tổ chức triển khai kẽ và hoàn toàn có thể ở vùng thấp của phổi. X-quang phổi có giá trị sàng lọc cao với độ nhạy trên 90 % với những trường hợp lao phổi AFB ( + ). Cần tăng cường sử dụng X-quang phổi tại những cơ sở y tế cho những trường hợp có triệu chứng hô hấp để sàng lọc lao phổi. Tuy nhiên cần chú ý quan tâm độ đặc hiệu không cao, nên không chứng minh và khẳng định chẩn đoán lao phổi chỉ bằng 1 phim X-quang phổi. Xquang phổi còn có công dụng nhìn nhận cung ứng với điều trị thử bằng kháng sinh thường thì trước khi chẩn đoán lao phổi không có vật chứng vi trùng và để nhìn nhận kế quả điều trị lao sau 2 tháng và kết thúc điều trị .
2.3. Chẩn đoán xác định
2.3.1. Chẩn đoán xác định lao phổi khi có tổn thương trên Xquang phổi nghi lao và một trong 2 tiêu chuẩn sau:
– Có dẫn chứng về sự xuất hiện của vi trùng lao trong bệnh phẩm lâm sàng như đờm, dịch phế quản, dịch dạ dày và những bệnh phẩm khác .
– Khi có những triệu chứng lâm sàng, cận lâm sàng nhưng không xác lập được vi trùng lao, chẩn đoán lao vẫn hoàn toàn có thể xác lập bằng tổng hợp những tín hiệu lâm sàng cận lâm sàng của thầy thuốc được giảng dạy chuyên khoa lao quyết định hành động .
2.3.2. Phân loại chẩn đoán dựa theo xét nghiệm soi đờm trực tiếp tìm AFB
– Lao phổi AFB(+): có ít nhất 1 mẫu đờm hoặc dịch phế quản, dịch dạ dày có kết quả soi trực tiếp AFB(+) tại các phòng xét nghiệm được kiểm chuẩn bởi Chương trình chống lao Quốc gia.
– Lao phổi AFB(-): khi có ít nhất 2 mẫu đờm AFB(-), người bệnh cần được thực hiện quy trình chẩn đoán lao phổi AFB(-) (xem phụ lục 2).
Người bệnh được chẩn đoán lao phổi AFB ( – ) cần thỏa mãn nhu cầu 1 trong 2 điều kiện kèm theo sau :
+ Có dẫn chứng vi trùng lao trong đờm, dịch phế quản, dịch dạ dày bằng giải pháp nuôi cấy hoặc những kỹ thuật mới như Xpert MTB / RIF .
+ Được thầy thuốc chuyên khoa chẩn đoán và chỉ định một phác đồ điều trị lao rất đầy đủ dựa trên ( 1 ) lâm sàng, ( 2 ) không bình thường nghi lao trên X-quang phổi và ( 3 ) thêm 1 trong 2 tiêu chuẩn sau : HIV ( + ) hoặc không phân phối với điều trị kháng sinh phổ rộng .
2.3.3. Lao kê: là một trong các thể lao phổi.
Là thể lao lan tỏa body toàn thân, biểu lộ rõ nhất ở phổi, hoàn toàn có thể có tổn thương màng não, gan, tủy xương hay nhiều bộ phận quan trọng khác. Hay xảy ra ở trẻ nhỏ, người nhiễm HIV hay bị suy giảm miễn dịch .
Lâm sàng : triệu chứng cơ năng thường rầm rộ : sốt cao, khó thở, tím tái. Triệu chứng thực thể tại phổi nghèo nàn ( hoàn toàn có thể chỉ nghe thấy tiếng thở thô ). Ở những người bệnh suy kiệt triệu chứng lâm sàng hoàn toàn có thể không rầm rộ .
Chẩn đoán xác lập : lâm sàng : cấp tính với những triệu chứng ho, sốt cao, khó thở, hoàn toàn có thể tím tái. X-quang phổi có nhiều nốt mờ, size đều, đậm độ đều và phân bổ khắp 2 phổi ( 3 đều : kích cỡ, tỷ lệ và đậm độ cản quang những hạt kê trên phim X-quang phổi ). Xét nghiệm đờm thường âm tính. Ngoài ra xét nghiệm vi trùng trong những mẫu bệnh phẩm ( dịch phế quản, dịch não tủy, máu ) hoàn toàn có thể dương thế .
2.4. Chẩn đoán phân biệt: Giãn phế quản, ung thư phổi, viêm phổi, áp xe phổi, bệnh phổi tắc nghẽn mạn tính, bệnh phổi ký sinh trùng. Ở người có HIV cần phân biệt với viêm phổi, nhất là viêm phổi do Pneumocystis jiroveci hay còn gọi là Pneumocystis carinii (PCP). Trong quá trình quản lý các bệnh mạn tính ở phổi như hen, COPD, bệnh phổi kẽ, bụi phổi,… cần lưu ý sàng lọc lao phổi phối hợp.
3. CHẨN ĐOÁN LAO NGOÀI PHỔI
3.1. Chẩn đoán lao ngoài phổi
Lao ngoài phổi là thể lao khó chẩn đoán – do vậy để tiếp cận chẩn đoán, người thầy thuốc trong quy trình thăm khám người bệnh phải hướng tới và tìm kiếm những tín hiệu của bệnh lao, phân biệt với những bệnh lý ngoài lao khác và chỉ định làm những kỹ thuật, xét nghiệm để từ đó chẩn đoán xác lập dựa trên :
– Các triệu chứng, tín hiệu ở cơ quan ngoài phổi nghi bệnh .
– Luôn tìm kiếm xem có lao phổi phối hợp không, sàng lọc ngay bằng Xquang phổi. Nếu có lao phổi sẽ là cơ sở quan trọng cho chẩn đoán lao ngoài phổi .
– Lấy bệnh phẩm từ những vị trí tổn thương để xét nghiệm :
+ Tìm vi trùng bằng kỹ thuật nhuộm soi trực tiếp, nuôi cấy, Xpert MTB / RIF ( với bệnh phẩm dịch não tủy, đờm, dịch phế quản, dịch dạ dày, dịch ( mủ ) những màng, mủ tổn thương hạch, xương, tai, khớp, … ) .
+ Xét nghiệm mô bệnh, tế bào học xác lập hình ảnh tổn thương lao .
– Chẩn đoán lao ngoài phổi đơn thuần không tích hợp với lao phổi thường khó khăn vất vả, cần dựa vào triệu chứng nghi lao ( sốt về chiều lê dài, ra mồ hôi đêm hôm, sút cân ) ; triệu chứng tại chỗ nơi cơ quan bị tổn thương, rủi ro tiềm ẩn mắc lao .
– Mức độ đúng chuẩn của chẩn đoán phụ thuộc vào nhiều vào năng lực phát hiện của những kỹ thuật tương hỗ như : X-quang, siêu âm, sinh thiết, xét nghiệm vi trùng học .
– Cần luôn chẩn đoán phân biệt với những bệnh khác .
– Các thầy thuốc được huấn luyện và đào tạo chuyên khoa tập hợp nghiên cứu và phân tích những triệu chứng tín hiệu để quyết định hành động chẩn đoán và chỉ định phác đồ điều trị .
3.2. Chẩn đoán một số lao ngoài phổi thường gặp
3.2.1. Lao hạch
Lâm sàng : Vị trí thường gặp nhất là hạch cổ, nổi bật là dọc cơ ức đòn chũm, nhưng cũng hoàn toàn có thể ở những vị trí khác. Hạch sưng to, lúc đầu hạch chắc, riêng rẽ, di động, không đau sau đó dính vào nhau và tổ chức triển khai dưới da, kém di động, hạch nhuyễn hóa, rò mủ. Có thể khỏi và để lại sẹo xấu .
Chẩn đoán xác lập : sinh thiết hạch, chọc hút hạch xét nghiệm mô bệnh học, tế bào thấy chất hoại tử bã đậu, tế bào bán liên, tế bào lympho, nang lao ; nhuộm soi trực tiếp tìm thấy AFB ; ngoài những hoàn toàn có thể tìm vi trùng lao bằng chiêu thức nuôi cấy bệnh phẩm chọc hút hạch. Bệnh phẩm mủ hoàn toàn có thể xét nghiệm Xpert .
3.2.2. Tràn dịch màng phổi (TDMP) do lao
Triệu chứng lâm sàng : đau ngực, khó thở tăng dần, khám phổi có hội chứng 3 giảm .
Xquang ngực thấy hình mờ đậm thuần nhất, mất góc sườn hoành, đường cong Damoiseau. Siêu âm màng phổi có dịch .
Chẩn đoán xác lập : chọc hút khoang màng phổi thấy dịch màu vàng chanh, rất hiếm khi dịch màu hồng, dịch tiết, lợi thế thành phần tế bào lymphô ; hoàn toàn có thể tìm thấy dẫn chứng vi trùng lao trong dịch màng phổi bằng nhuộm soi trực tiếp và nuôi cấy. Sinh thiết màng phổi mù hoặc qua soi màng phổi để lấy bệnh phẩm chẩn đoán vi trùng học hoặc mô bệnh tế bào. Dịch màng phổi hoàn toàn có thể xét nghiệm Xpert .
3.2.3. Tràn dịch màng tim (TDMT) do lao
Triệu chứng lâm sàng : những triệu chứng phụ thuộc vào vào số lượng dịch và vận tốc hình thành dịch màng tim. Triệu chứng thường gặp gồm có : đau ngực, khó thở, tĩnh mạch cổ nổi, phù chi dưới. Khám có tim nhịp nhanh, huyết áp kẹt, mạch đảo ngược nếu có hội chứng ép tim cấp. Nghe có tiếng cọ màng tim ở quy trình tiến độ sớm hoặc tiếng tim mờ khi tràn dịch nhiều .
Xquang ngực thấy bóng tim to, hình giọt nước, hình đôi bờ. Điện tim có điện thế thấp ở những chuyển đạo, sóng T âm và ST chênh. Siêu âm có dịch màng ngoài tim .
Chẩn đoán xác lập : chọc hút dịch màng tim, dịch thường màu vàng chanh, dịch tiết, tế bào lympho chiếm lợi thế. Có thể tìm thấy dẫn chứng vi trùng lao trong dịch màng tim bằng nhuộm soi trực tiếp và nuôi cấy. Dịch màng tim hoàn toàn có thể xét nghiệm Xpert .
3.2.4. Tràn dịch màng bụng (TDMB) do lao
Triệu chứng lâm sàng : có những tín hiệu tràn dịch màng bụng ( gõ đục vùng thấp biến hóa theo tư thế, “ sóng vỗ ”, tín hiệu gõ đục “ ô bàn cờ ” tiến trình muộn, … ). Có thể sờ thấy những u cục, đám cứng trong ổ bụng. Có thể có tín hiệu tắc hoặc bán tắc ruột do những hạch dính vào ruột .
Siêu âm ổ bụng có những hình ảnh gợi ý lao màng bụng : hạch mạc treo to, hạch sau màng bụng, dịch khu trú giữa những đám dính, nội soi ổ bụng thấy những hạt lao .
Chẩn đoán xác lập : chọc hút dịch màng bụng màu vàng chanh, nhiều lúc đục, dịch tiết, tế bào lympho chiếm lợi thế. Có thể tìm thấy vật chứng vi trùng lao trong dịch màng bụng bằng nhuộm soi trực tiếp, nuôi cấy. Soi ổ bụng và sinh thiết là kỹ thuật rất có giá trị cho chẩn đoán trong hầu hết những trường hợp. Trên tiêu bản sinh thiết thấy hoại tử bã đậu, nang lao. Dịch màng bụng hoàn toàn có thể xét nghiệm Xpert .
3.2.5. Lao màng não – não
Triệu chứng lâm sàng : bệnh cảnh viêm màng não khởi phát bằng đau đầu tăng dần và rối loạn tri giác. Khám thường thấy có tín hiệu cổ cứng và tín hiệu Kernig ( + ). Có thể có tín hiệu tổn thương dây thần kinh sọ não và tín hiệu thần kinh khu trú ( thường liệt dây 3, 6, 7, rối loạn cơ tròn ). Các tổn thương tủy sống hoàn toàn có thể gây ra liệt 2 chi dưới ( liệt cứng hoặc liệt mềm ) .
Chọc dịch não tủy áp lực đè nén tăng, dịch hoàn toàn có thể trong ( tiến trình sớm ), ánh vàng ( tiến trình muộn ), có khi vẩn đục. Xét nghiệm sinh hóa dịch não tủy thường thấy protein tăng và đường giảm. Tế bào trong dịch não tủy tăng vừa thường dưới 600 tế bào / mm3 và tế bào lympho chiếm lợi thế, ở tiến trình sớm tỷ suất neutro tăng nhưng không có bạch cầu thoái hóa ( mủ )
Chẩn đoán xác lập : dựa vào bệnh cảnh lâm sàng, đặc thù dịch não tủy và xét nghiệm sinh hóa tế bào dịch não tủy, hoàn toàn có thể tìm thấy dẫn chứng vi trùng lao trong dịch màng não bằng nuôi cấy ( tỷ suất dương thế cao hơn khi nuôi cấy trên môi trường tự nhiên lỏng ), nhuộm soi trực tiếp AFB ( + ) với tỷ suất rất thấp. Dịch màng não hoàn toàn có thể xét nghiệm Xpert
Chụp MRI não hoàn toàn có thể thấy hình ảnh màng não dày và tổn thương ở não gợi ý lao, ngoài những chụp MRI não giúp chẩn đoán phân biệt bệnh lý khác ở não ( U não, Viêm não, Áp xe não, Sán não … ) .
Chẩn đoán loại trừ với những căn nguyên khác như : viêm màng não mủ, viêm màng não nước trong và những bệnh lý thần kinh khác .
3.2.6. Lao xương khớp
Triệu chứng lâm sàng : hay gặp ở cột sống với đặc thù : đau lưng, hạn chế hoạt động, đau tại chỗ tương ứng với đốt sống bị tổn thương ( quá trình sớm ) ; quá trình muộn gây biến dạng gù cột sống hoặc có tín hiệu chèn ép tủy gây liệt .
Ngoài cột sống lao còn hay gặp ở những khớp lớn với biểu lộ : sưng đau khớp lê dài, không sưng đỏ, không đối xứng, hoàn toàn có thể dò mủ bã đậu .
Chụp Xquang, CT, MRI cột sống, khớp thấy hẹp khe đốt, xẹp đốt sống hình chêm, hoàn toàn có thể thấy mảnh xương chết và hình áp xe lạnh cạnh cột sống, hẹp khe khớp .
Chẩn đoán xác lập : dựa vào lâm sàng và những đặc thù tổn thương trên Xquang, CT, MRI cột sống, khớp. Nếu có áp xe lạnh, dò mủ xét nghiệm mủ áp xe tìm AFB cho tỷ suất dương thế cao. Sinh thiết tổ chức triển khai được cho phép chẩn đoán mô bệnh tế bào. Dịch mủ khớp hoàn toàn có thể xét nghiệm Xpert
3.2.7. Lao tiết niệu – sinh dục
Lâm sàng : hay gặp triệu chứng rối loạn bài tiết nước tiểu ( đái buốt, đái rắt ) lê dài từng đợt, điều trị kháng sinh đỡ sau đó lại bị lại, hoàn toàn có thể đái máu không có máu cục, đái đục, đau thắt lưng âm ỉ .
Lao sinh dục nam : sưng đau tinh hoàn, mào tinh hoàn, ít gặp viêm cấp tính, tràn dịch màng tinh hoàn .
Lao sinh dục nữ : ra khí hư, rối loạn kinh nguyệt, từ từ “ mất kinh ”, vô sinh .
Chẩn đoán xác lập : tìm thấy vi trùng lao trong nước tiểu, dịch màng tinh hoàn, dịch dò, khí hư bằng nuôi cấy ( tỷ suất dương thế cao hơn khi cấy trên thiên nhiên và môi trường lỏng ), nhuộm soi trực tiếp AFB ( + ) với tỷ suất rất thấp. Chụp UIV thấy hình ảnh gợi ý lao ( đài thận cắt cụt, hang lao, niệu quản chít hẹp … ). Soi bàng quang, soi tử cung và sinh thiết xét nghiệm mô bệnh, tế bào có nang lao, xét nghiệm vi trùng lao. Chọc hút dịch màng tinh hoàn ( có đặc thù như lao những màng khác trong khung hình ), chọc dò “ u ” tinh hoàn xét nghiệm tế bào có viêm lao. Dịch mủ hoàn toàn có thể xét nghiệm Xpert .
3.2.8. Các thể lao khác ít gặp hơn: lao da, lao lách, lao gan, v.v… chẩn đoán hoặc có phối hợp với lao phổi hoặc bằng sinh thiết chẩn đoán mô bệnh tế bào.
4. CHẨN ĐOÁN LAO KHÁNG THUỐC (SƠ ĐỒ CHẨN ĐOÁN- PHỤ LỤC 3)
Các nhóm đối tượng được làm Xpert MTB/RIF để chẩn đoán kháng thuốc
( 1 ) Người bệnh lao thất bại phác đồ điều trị lao không kháng Rifampicin ( gồm có lao nhạy cảm, kháng đơn và nhiều thuốc )
( 2 ) Người nghi lao mới hoặc người bệnh lao mới có tiếp xúc với người bệnh lao đa kháng .
( 3 ) Người bệnh lao không âm hóa đờm sau 2 hoặc 3 tháng điều trị phác đồ lao không kháng Rifampicin
( 4 ) Người bệnh lao tái phát phác đồ lao không kháng Rifampicin ( nhóm “ 4 a ” ), lao kháng Rifampicin ( nhóm “ 4 b ” )
( 5 ) Người bệnh lao điều trị lại sau bỏ trị ( lao không kháng Rifampicin : nhóm “ 5 a ” ; lao kháng Rifampicin : nhóm “ 5 b ” )
(6) Người bệnh lao mới có HIV (+)
( 7 ) Các trường hợp khác : Bao gồm người nghi lao hoặc người bệnh lao có tiền sử dùng thuốc lao trên 1 tháng ( gồm có cả người nghi lao tái phát, người nghi lao sau bỏ trị, người nghi lao hoặc người bệnh lao có tiền sử điều trị lao ở y tế tư nhưng không rõ tác dụng điều trị )
( 8 ) Người bệnh lao phổi mới ( * )
( * ) Sàng lọc trong số AFB ( + ) hoặc lan rộng ra tới AFB ( – ) tùy chủ trương và nguồn lực của CTCLQG tại mỗi tiến trình
Lâm sàng:
– Người bệnh khi đang điều trị lao nhưng những triệu chứng sốt, ho, khạc đờm không thuyên giảm hoặc thuyên giảm một thời hạn rồi lại Open trở lại với những triệu chứng tăng lên, bệnh nhân liên tục sút cân .
– Tuy nhiên bệnh lao kháng thuốc hoàn toàn có thể được chẩn đoán ở người chưa khi nào mắc lao và triệu chứng lâm sàng của lao đa kháng hoàn toàn có thể không độc lạ so với bệnh lao thường thì .
Cận lâm sàng:
– Xét nghiệm AFB, nuôi cấy dương thế liên tục hoặc âm tính một thời hạn rồi dương thế trở lại hoặc âm tính, dương thế xen kẽ ở người đang điều trị lao .
– Xét nghiệm kháng sinh đồ cho tác dụng kháng với những thuốc chống lao hàng 1, hàng 2 .
– Các kỹ thuật sinh học phân tử hoàn toàn có thể chẩn đoán nhanh lao đa kháng, tiền / siêu kháng thuốc và để phân biệt với trực khuẩn lao không nổi bật : LPA với thuốc lao hàng 1, thuốc lao hàng 2 ( Hain test ), Xpert MTB / RIF .
– Hình ảnh tổn thương trên phim Xquang phổi không đổi khác hoặc Open thêm tổn thương mới trong quy trình điều trị đúng phác đồ có trấn áp. Trường hợp lao kháng thuốc phát hiện ở người chưa khi nào mắc lao, hình ảnh tổn thương trên phim Xquang hoàn toàn có thể không độc lạ so với bệnh lao thường thì .
Chẩn đoán xác định lao kháng thuốc:
Căn cứ vào hiệu quả kháng sinh đồ hoặc những xét nghiệm chẩn đoán nhanh được WHO xác nhận ( Hain test, Xpert MTB / RIF … ), tiêu chuẩn chẩn đoán cho những thể bệnh lao kháng thuốc được xác lập như sau :
– Kháng đơn thuốc : Chỉ kháng với duy nhất một thuốc chống lao hàng một khác Rifampicin
– Kháng nhiều thuốc : Kháng với từ hai thuốc chống lao hàng một trở lên mà không kháng với Rifampicin
– Lao kháng Rifampicin : Kháng với Rifampicin, có hoặc không kháng thêm với những thuốc lao khác kèm theo ( hoàn toàn có thể là kháng đơn thuốc, kháng nhiều thuốc, đa kháng thuốc hoặc siêu kháng thuốc ). Tuy nhiên ở Nước Ta lúc bấy giờ, những chủng đã kháng với Rifampicin thì có tới trên 90 % có kèm theo kháng Isoniazid, thế cho nên khi phát hiện kháng Rifampicin người bệnh được coi như đa kháng thuốc và thu nhận điều trị phác đồ đa kháng
– Đa kháng thuốc ( MDR-TB ) : Kháng đồng thời với tối thiểu hai thuốc chống lao là Isoniazid và Rifampicin
– Tiền siêu kháng : Lao đa kháng có kháng thêm với bất kỳ thuốc nào thuộc nhóm Fluoroquinolone hoặc với tối thiểu một trong ba thuốc tiêm hàng hai Capreomycin, Kanamycin, Amikacin, ( chứ không đồng thời cả 2 loại thêm ) .
– Siêu kháng thuốc ( XDR-TB ) : Lao đa kháng có kháng thêm với bất kể thuốc nào thuộc nhóm Fluoroquinolone và bất kỳ thuốc nào trong ba thuốc tiêm hàng hai ( Capreomycin, Kanamycin, Amikacin ) .
5. CHẨN ĐOÁN LAO ĐỒNG NHIỄM HIV
5.1. Chẩn đoán nhiễm HIV ở người bệnh lao
Tất cả những người bệnh lao cần được cung ứng tư vấn và xét nghiệm HIV theo quá trình PITC tức là cán bộ y tế dữ thế chủ động tư vấn, yêu cầu và phân phối dịch vụ xét nghiệm HIV cho người bệnh lao của Bộ Y tế. ( PITC : Provider Initiated HIV Testing and Counseling ) .
5.1.1. Tư vấn trước xét nghiệm chẩn đoán HIV
Hình thức tư vấn tùy từng đối tượng người tiêu dùng và điều kiện kèm theo đơn cử hoàn toàn có thể vận dụng hình thức tư vấn sau đây :
– Tư vấn theo nhóm, ví dụ : cho những nhóm phạm, can phạm ; nhóm học viên những TT chữa bệnh – dạy nghề, …
– Tư vấn cho từng cá thể .
– Ngoài ra tờ rơi, tờ bướm tuyên truyền … hoàn toàn có thể được sử dụng trong quy trình tư vấn .
Nội dung tư vấn bao gồm:
– Tìm hiểu về tiền sử làm xét nghiệm chẩn đoán HIV của người bệnh và những hành vi rủi ro tiềm ẩn lây truyền HIV
– Giải thích nguyên do và quyền lợi của việc xét nghiệm HIV để chẩn đoán, điều trị và dự trữ so với người bệnh, những thông tin sau cần được cung ứng cho người bệnh :
+ Người mắc lao cũng có năng lực bị nhiễm HIV
+ Chẩn đoán HIV sớm và điều trị thích hợp lao và HIV sẽ cho tác dụng tốt hơn điều trị lao đơn thuần .
– Xác nhận tính tự nguyện và bảo mật thông tin của xét nghiệm chẩn đoán HIV
– Khẳng định việc phủ nhận xét nghiệm HIV sẽ không ảnh hưởng tác động đến năng lực tiếp cận của người bệnh so với những dịch vụ khám chữa bệnh khác
– Giới thiệu về dịch vụ chuyển tiếp nếu như hiệu quả xét nghiệm là dương thế
– Giải đáp những vướng mắc – do dự của người bệnh .
5.1.2. Xét nghiệm chẩn đoán nhiễm HIV
– Khi người bệnh chấp thuận đồng ý, họ sẽ ký một bản cam kết và bản cam kết này được lưu lại trong hồ sơ người bệnh .
– Máu của người bệnh được tích lũy và gửi đến cơ sở y tế có năng lực thực thi test sàng lọc tại những đơn vị chức năng PITC thuộc Chương trình chống lao. Nếu test sàng lọc có tác dụng dương thế, mẫu máu sẽ được liên tục gửi đến phòng xét nghiệm được phép khẳng định chắc chắn HIV gần nhất triển khai. Thông thường hiệu quả sẽ có sau 7 – 10 ngày sau khi mẫu máu được gửi xét nghiệm .
5.1.3. Trả kết quả – Tư vấn sau khi có kết quả xét nghiệm
Tùy theo hiệu quả ở đầu cuối, nhân viên cấp dưới y tế nơi tư vấn sẽ chọn một trong những trường hợp sau để liên tục tư vấn cho người mắc lao :
Nếu kết quả xét nghiệm chẩn đoán HIV âm tính:
– Thông báo cho người bệnh hiệu quả xét nghiệm âm tính .
– Tư vấn giúp người bệnh hiểu đúng về tác dụng xét nghiệm và ý nghĩa của quá trình hành lang cửa số đồng thời khuyên người bệnh nên xét nghiệm lại sau 6 đến 12 tuần ở một TT tư vấn xét nghiệm HIV tự nguyện ( nếu có yếu tố rủi ro tiềm ẩn ) .
– Tư vấn cho người bệnh về rủi ro tiềm ẩn lây nhiễm HIV và giải pháp dự trữ, kể cả khuyên bạn tình của họ cần được xét nghiệm chẩn đoán HIV .
– Giới thiệu chuyển tiếp người bệnh đến những dịch vụ can thiệp dự trữ lây nhiễm HIV nếu họ có nhu yếu .
Nếu kết quả xét nghiệm chẩn đoán HIV dương tính:
– Thông báo tác dụng xét nghiệm HIV cho người bệnh biết, lý giải cho người bệnh về hiệu quả xét nghiệm .
– Hỗ trợ ý thức, tâm ý cho người bệnh .
– Tư vấn cho người bệnh về sự thiết yếu của chăm nom – điều trị HIV, thông tin những dịch vụ tương hỗ sẵn có tiếp theo cho người bệnh .
– Tư vấn những việc làm thiết yếu ngay : liên tục điều trị bệnh lao, dự trữ những bệnh lây truyền cho bản thân và người thân trong gia đình .
– Trao đổi với người bệnh cách bật mý hiệu quả HIV dương thế cho vợ, chồng, người thân trong gia đình … động viên tư vấn những người này xét nghiệm HIV tự nguyện .
– Giới thiệu, hội chẩn với cơ sở điều trị, tạo điều kiện kèm theo chuyển tiếp người bệnh đến những dịch vụ chăm nom HIV để được ĐK điều trị ARV sớm nhất hoàn toàn có thể và điều trị dự trữ bằng Cotrimoxazol .
– Sau trình làng cần theo dõi tương hỗ liên tục để chắn chắn người bệnh tiếp cận được dịch vụ .
Nếu kết quả xét nghiệm chẩn đoán HIV là không xác định:
– Giải thích để người bệnh hiểu đúng về tác dụng xét nghiệm .
– Hỗ trợ ý thức, tâm ý cho người bệnh .
– Tư vấn về những giải pháp dự trữ lây nhiễm HIV .
– Hẹn xét nghiệm lại sau 14 ngày .
5.2. Chẩn đoán lao ở người có HIV
Biểu hiện lâm sàng, cận lâm sàng của bệnh lao ở người có HIV thường không nổi bật và tiến triển nhanh dẫn tới tử trận .
Tại những cơ sở y tế, đặc biệt quan trọng những phòng khám ngoại trú cho người nhiễm HIV cần luôn sàng lọc lao cho người nhiễm HIV mỗi lần đến khám do bất kể nguyên do nào .
Chẩn đoán mắc lao ở người nhiễm HIV do thầy thuốc quyết định hành động, dựa trên yếu tố rủi ro tiềm ẩn mắc lao, những bộc lộ lâm sàng và cận lâm sàng như sau :
5.2.1. Các yếu tố nguy cơ mắc lao ở người nhiễm HIV
– Người bệnh có tiền sử điều trị lao.
– Người bệnh có tiếp xúc với nguồn lây lao.
– Người bệnh có tiền sử chữa bệnh trong các cơ sở cai nghiện hoặc ở trại giam.
– Tình trạng suy dinh dưỡng.
– Tiền sử nghiện rượu, ma túy.
5.2.2. Các dấu hiệu lâm sàng
Sàng lọc bệnh lao ở người HIV nhằm mục đích loại trừ năng lực mắc lao để cung ứng điều trị dự trữ bằng INH theo lao lý đồng thời phát hiện những không bình thường nghi lao hoặc không loại trừ được bệnh lao để chuyển khám chuyên khoa phát hiện bệnh lao .
Người nhiễm HIV nếu không có cả 4 triệu chứng sau đây hoàn toàn có thể loại trừ được không mắc lao tiến triển và hoàn toàn có thể xem xét điều trị dự trữ lao bằng INH :
– Ho.
– Sốt nhẹ về chiều.
– Sút cân.
– Ra mồ hôi trộm.
Nếu có tối thiểu 1 hoặc nhiều triệu chứng trên thì cần gửi khám chuyên khoa phát hiện bệnh lao. Các tín hiệu này thường diễn tiến nhanh và ít cung ứng với những điều trị thường thì. Người nhiễm HIV nếu có bất kể tín hiệu hô hấp nào cũng cần được khám sàng lọc phát hiện lao phổi .
Về thực hành thực tế lâm sàng, thầy thuốc cần nhìn nhận thực trạng người bệnh xem có tín hiệu nguy hại, gồm có : không tự đi lại được, nhịp thở > 30 lần / phút, sốt cao > 39 độ C, mạch nhanh > 120 lần / phút ở người có HIV để có những có những quyết định hành động xử trí chẩn đoán và điều trị tương thích. ( Xem sơ đồ xử trí phụ lục 5 )
5.2.3. Cận lâm sàng
Vi khuẩn học:
– Xét nghiệm đờm: tùy theo điều kiện cơ sở vật chất và tổ chức, có thể thực hiện như sau:
+ Nhuộm soi đờm trực tiếp : được vận dụng ở tuyến huyện hoặc những điểm kính. Cần chú ý hướng dẫn người bệnh lấy đờm đúng cách, hoàn toàn có thể 2 mẫu tại chỗ cách nhau tối thiểu 2 giờ. Thời gian cho tác dụng trong ngày đến khám .
+ Xpert MTB / RIF : là xét nghiệm ưu tiên dùng để chẩn đoán lao cho người có HIV. Thời gian cho tác dụng khoảng chừng 2 giờ .
+ Cấy đờm : được triển khai khi nhuộm soi đờm trực tiếp có hiệu quả AFB âm tính. Áp dụng ở những nơi có điều kiện kèm theo cơ sở vật chất tương thích như bệnh viện tuyến tỉnh trở lên. Cơ sở không có năng lực nuôi cấy, hoàn toàn có thể lấy mẫu đờm chuyển đến những phòng xét nghiệm triển khai nuôi cấy. Thời gian hoàn toàn có thể cho tác dụng dương thế sau 2 tuần khi nuôi cấy ở môi trường tự nhiên lỏng ( MGIT ) .
– Bệnh phẩm khác cũng có khả năng tìm thấy vi khuẩn lao: trong dịch màng phổi, dịch màng tim, dịch màng bụng, dịch màng não, hạch,…
Chẩn đoán hình ảnh:
– X-quang:
+ Lao phổi : ở quy trình tiến độ lâm sàng nhiễm HIV sớm, khi sức đề kháng chưa ảnh hưởng tác động nhiều, hình ảnh tổn thương trên X-quang ngực không độc lạ so với ở người HIV âm tính. Ở tiến trình muộn, tổn thương thường lan tỏa 2 phế trường với những hình ảnh tổn thương dạng nốt, lợi thế tổ chức triển khai link lan tỏa, ít thấy hình ảnh hang, hoàn toàn có thể gặp hình ảnh hạch rốn phổi, hạch cạnh phế quản … cần phân biệt với viêm phổi do Pneumocystis Carinii ( PCP ) .
+ Lao ngoài phổi : hình ảnh tùy theo cơ quan – bộ phận tổn thương .
– Chụp cắt lớp vi tính (CT scan): thấy hình ảnh các tổn thương như hang lao hoặc các tổn thương gợi ý lao.
Mô bệnh học – giải phẫu bệnh: sinh thiết hạch, chọc hạch để thực hiện chẩn đoán mô bệnh tế bào học có các thành phần đặc trưng như hoại tử bã đậu, tế bào bán liên, nang lao, có thể thấy AFB nếu nhuộm ZN.
Chẩn đoán lao ở người nhiễm HIV
– Dựa vào lâm sàng: sàng lọc 4 triệu chứng ho, sốt, sút cân, ra mồ hôi đêm với bất kỳ thời gian nào.
– Cận lâm sàng: khi có bất thường nghi lao trên phim X-quang ở bệnh nhân có triệu chứng nghi lao kể trên, có thể chẩn đoán xác định lao. Các xét nghiệm khác: xét nghiệm đờm nhuộm soi trực tiếp, nuôi cấy môi trường lỏng MGIT, cần ưu tiên chỉ định xét nghiệm Xpert MTB/RIF cho người có HIV.
Chẩn đoán loại trừ lao tiến triển ở người nhiễm HIV
Khi sàng lọc lâm sàng người bệnh không có bất kể triệu chứng nào trong 4 triệu chứng ( ho, sốt, sụt cân, ra mồ hôi trộm ) thì hoàn toàn có thể loại trừ lao hoạt động giải trí và hoàn toàn có thể chỉ định điều trị lao tiềm ẩn bằng INH sớm .
Quy trình chẩn đoán lao phổi ở người HIV(+) (xem phụ lục 4 và 5)
6. CHẨN ĐOÁN BỆNH LAO Ở TRẺ EM
6.1. Các dấu hiệu nhận biết sớm bệnh lao ở trẻ em:
Khi trẻ có những tín hiệu dưới đây cần được những bác sĩ làm chẩn đoán xác lập bệnh lao :
6.1.1. Tiền sử:
– Tiền sử tiếp xúc thân thiện với người bệnh lao phổi, trong vòng 1-2 năm gần đây .
– Tiền sử có những triệu chứng lâm sàng nghi lao đã được điều trị nhưng triệu chứng không hoặc ít cải tổ, nhanh tái phát .
6.1.2. Triệu chứng lâm sàng nghi lao:
– Triệu chứng body toàn thân : Sốt, ra mồ hôi đêm ; stress / giảm chơi đùa ; chán ăn / không tăng cân / sụt cân / suy dinh dưỡng .
– Triệu chứng cơ năng : tùy thuộc vào cơ quan mắc lao, những triệu chứng thường lê dài trên 2 tuần, không cải tổ với liệu pháp điều trị khác ngoài lao .
– Triệu chứng thực thể : nghèo nàn hoặc rầm rộ tùy từng cơ quan bị bệnh và quá trình tiến triển của bệnh .
6.1.3. Xquang:
– Các hình ảnh tổn thương nghi lao trẻ nhỏ thường gặp trên phim Xquang ngực thường quy :
● Hạch bạch huyết cạnh khí phế quản hoặc hạch rốn phổi to bộc lộ là hình mờ tròn hoặc bầu dục
● Nốt, đông đặc nhu mô phổi
● Nốt kê
● Hang lao
● Hình ảnh tràn dịch màng phổi, màng tim
● Hình ảnh dày rãnh liên thùy phổi, hoàn toàn có thể kèm theo hình ảnh tràn dịch khu trú .
Chụp Xquang ngực giúp xác lập những tổn thương lao tại phổi phối hợp với lao những cơ quan khác .
– Hình ảnh tổn thương nghi lao cột sống : thân đốt sống bị hủy hoại tạo thành hình chêm ( trên phim nghiêng ), hoàn toàn có thể thấy hình ảnh ổ áp xe lạnh ở hai bên cạnh những đốt sống tổn thương ( phim thẳng ) .
– Hình ảnh tổn thương xương khớp nghi lao : hình ảnh ổ khớp, cổ / thân xương bị tàn phá, ổ khuyết xương, tràn dịch ổ khớp .
6.1.4. Tìm thấy vi khuẩn lao: đây là tiêu chuẩn vàng để chẩn đoán bệnh lao
– Bệnh phẩm : bất kể bệnh phẩm nào hoàn toàn có thể lấy được tùy theo thể bệnh : Đờm, dịch dạ dày, dịch những màng, dịch phế quản, dịch não tủy, mủ hạch, phân, mủ áp xe, ….
– Kỹ thuật xét nghiệm : Xpert MTB / RIF, nhuộm soi trực tiếp, nuôi cấy, …
6.1.5. Xét nghiệm nhiễm lao:
Tét da hoặc IGRA dương thế cho biết trẻ đã nhiễm lao nhưng không chứng minh và khẳng định trẻ đang mắc lao. Các xét nghiệm này âm tính cũng chưa loại trừ trẻ có mắc lao ( khi có sự Open những yếu tố mục 6.2 )
6.1.6. Các xét nghiệm khác:
– Xét nghiệm giải phẫu bệnh ( tế bào – mô bệnh học ) : lao hạch, lao những màng, lao xương khớp, …
– Chẩn đoán hình ảnh : Siêu âm, CT scan, MRI, … những cơ quan nghi lao
– Xét nghiệm HIV : những trẻ nhiễm HIV cần được sàng lọc mắc lao và ngược lại .
– Xét nghiệm TCD8, TCD4
6.2. Chẩn đoán lao phổi ở trẻ em:
Trẻ được chẩn đoán mắc lao phổi khi thỏa mãn nhu cầu một trong hai điều kiện kèm theo sau :
1. Trẻ có triệu chứng nghi lao và xét nghiệm tìm vi trùng lao dương thế so với những bệnh phẩm lâm sàng : đờm, dịch dạ dày, dịch phế quản, phân .
2. Được những bác sĩ chuyên khoa hội chẩn chẩn đoán dựa trên :
– Triệu chứng lâm sàng : ho, sốt, ra mồ hôi đêm, sụt cân / không tăng cân, giảm chơi đùa trên 2 tuần
– Hình ảnh Xquang ngực nghi lao
– Không phân phối với điều trị kháng sinh phổ rộng 10-14 ngày
– Tiền sử tiếp xúc nguồn lây trong vòng 2 năm gần đây
– Tét da với Tuberculin / IGRA dương thế
(Sơ đồ chẩn đoán lao phổi trẻ em-phụ lục 6)
6.3. Chẩn đoán lao ngoài phổi trẻ em:
6.3.1. Lao hạch ngoại vi:
Lao hạch ngoại vi là thể lao gặp nhiều thứ 2 sau lao phổi ở trẻ nhỏ. Trẻ được chẩn đoán mắc lao hạch ngoại vi khi có những tín hiệu lâm sàng và cận lâm sàng sau :
6.3.1. 1. Lâm sàng :
– Hạch thường gặp ở vùng cổ, tiến triển chậm, to dần, kích cỡ trên 2 cm, không đối xứng, không đau, không đỏ, tiến trình muộn nếu không được điều trị hoàn toàn có thể dò chất bã đậu, lâu liền sẹo .
– Triệu chứng body toàn thân hoàn toàn có thể gặp : sốt, ra mồ hôi đêm, sụt cân
– Điều trị kháng sinh phổ rộng 1 – 2 tuần không cung ứng .
6.3.1. 2. Cận lâm sàng :
– Xét nghiệm tế bào học hoàn toàn có thể tìm thấy chất hoại tử bã đậu, tế bào bán liên, tế bào khổng lồ trong những bệnh phẩm lâm sàng hạch ( chọc hút, dịch mủ ) .
– Xét nghiệm mô bệnh học bệnh phẩm sinh thiết hạch có hình ảnh nang lao nổi bật : ở giữa là vùng hoại tử bã đậu, bao quanh là những tế bào bán liên, tế bào khổng lồ và tế bào lympho, ngoài cùng là lớp tế bào xơ .
– Soi trực tiếp, Xpert MTB / RIF hoặc nuôi cấy tìm vi trùng lao từ bệnh phẩm mủ hạch .
Lưu ý: Cần chẩn đoán phân biệt với hạch viêm phản ứng BCG
– Vị trí thường gặp là trong hố nách, thượng đòn cùng bên tiêm BCG, thường Open trong năm tiên phong sau tiêm .
– Xử trí tại chỗ, không dùng phác đồ điều trị lao hạch .
– Trường hợp hạch BCG lan tỏa cần hội chẩn chuyên khoa lao .
6.3.2. Chẩn đoán các thể lao ngoài phổi khác:
|
Vị trí Lao ngoài phổi |
Biểu hiện lâm sàng hay gặp |
Xét nghiệm |
Khuyến cáo |
|
|
Lao màng phổi |
Rì rào phế nang giảm và gõ đục Có thể có đau ngực |
Chụp Xquang Chọc dịch màng phổi * |
– Điều trị lao – Nếu dịch màng phổi có mủ xem năng lực viêm mủ màng phổi và chuyển lên tuyến trên . |
|
|
Trẻ em dưới 5 tuổi mắc thể lao lan tràn và nặng. |
||||
|
Lao màng não |
Đau đầu, không dễ chịu, quấy khóc, nôn, hôn mê / giảm hoặc mất ý thức, co giật, cổ cứng, thóp phồng, liệt, … |
– Chọc dò tủy sống lấy dịch não tủy * . – Xquang phổi |
Nhập viện điều trị lao * * | |
|
Lao kê |
Dấu hiệu lâm sàng hoàn toàn có thể rầm rộ : khó thở, sốt cao, tím tái ( không tương ứng với tín hiệu thực thể ở phổi ), hôn mê, suy kiệt … | Xquang phổi | Điều trị hoặc chuyển lên tuyến trên | |
|
Trẻ em từ 5 tuổi trở lên |
||||
|
Lao màng bụng |
Bụng to dần, cổ trướng, gõ đục vùng thấp hoặc có những đám cứng trong ổ bụng | Chọc hút dịch màng bụng * | Chuyển lên tuyến trên * * | |
|
Lao cột sống |
Đau cột sống vùng tổn thương, đau tăng khi hoạt động. Cột sống bị biến dạng, hoàn toàn có thể chân bị yếu / bị liệt | Chụp Xquang cột sống | Chuyển lên tuyến trên * * | |
|
Lao màng ngoài tim |
– Tim nhịp nhanh – Tiếng tim mờ – Mạch khó bắt – Khó thở |
Xquang lồng ngực Siêu âm tim, chọc dịch màng tim * |
Chuyển lên tuyến trên * * | |
|
Lao xương khớp |
– Gặp ở cuối những xương dài, khớp sưng biến dạng, hạn chế hoạt động . – Tràn dịch một bên, thường ở khớp gối hoặc khớp háng . |
Chụp Xquang / hút dịch ổ khớp * | Chuyển lên tuyến trên * * | |
* Đặc điểm: dịch lỏng màu vàng chanh, protein cao, nhuộm soi trực tiếp có các tế bào bạch cầu, chủ yếu là tế bào lympho.
** Nếu không chuyển được bắt đầu điều trị lao.
(Xem sơ đồ hướng dẫn quy trình chẩn đoán bệnh lao trẻ em ở phụ lục số 7)
7. PHÂN LOẠI BỆNH LAO
7.1. Phân loại bệnh lao theo vị trí giải phẫu
– Lao phổi: bệnh lao tổn thương ở phổi – phế quản, bao gồm cả lao kê. Trường hợp tổn thương phối hợp cả ở phổi và cơ quan ngoài phổi được phân loại là lao phổi.
– Lao ngoài phổi: bệnh lao tổn thương ở các cơ quan ngoài phổi như: màng phổi, hạch, màng bụng, sinh dục tiết niệu, da, xương, khớp, màng não, màng tim,… Nếu lao nhiều bộ phận, thì bộ phận có biểu hiện tổn thương nặng nhất (lao màng não, xương, khớp,…) được ghi là chẩn đoán chính.
7.2. Phân loại lao phổi theo kết quả xét nghiệm nhuộm soi trực tiếp
– Lao phổi AFB(+) và lao phổi AFB (-).
– Xem thêm tiêu chuẩn ở phần chẩn đoán.
7.3. Phân loại bệnh lao theo kết quả xét nghiệm vi khuẩn
– Bệnh nhân lao có dẫn chứng vi khuẩn học : là người bệnh có tác dụng xét nghiệm dương thế với tối thiểu một trong những xét nghiệm : nhuộm soi đờm trực tiếp ; nuôi cấy ; hoặc xét nghiệm vi trùng lao đã được TCYTTG xác nhận ( như Xpert MTB / RIF, HAIN ) .
– Bệnh nhân lao không có bằng chứng vi khuẩn học (chẩn đoán lâm sàng): là người bệnh được chẩn đoán và điều trị lao bởi thầy thuốc lâm sàng mà không đáp ứng được tiêu chuẩn có bằng chứng vi khuẩn học. Các trường hợp bệnh nhân lao không có bằng chứng vi khuẩn (chẩn đoán lâm sàng), sau đó trong quá trình điều trị tìm thấy vi khuẩn lao bằng các xét nghiệm cần được phân loại lại là bệnh nhân lao có bằng chứng vi khuẩn.
7.4. Phân loại bệnh nhân lao theo tiền sử điều trị lao
– Mới: người bệnh chưa bao giờ dùng thuốc chống lao hoặc mới dùng thuốc chống lao dưới 1 tháng.
– Tái phát: người bệnh đã được điều trị lao và được thầy thuốc xác định là khỏi bệnh, hay hoàn thành điều trị nay mắc bệnh trở lại với kết quả AFB(+) hoặc có bằng chứng vi khuẩn.
– Thất bại điều trị, khi người bệnh có:
○ AFB ( + ) từ tháng điều trị thứ 5 trở đi, phải chuyển phác đồ điều trị ,
○ có chẩn đoán khởi đầu AFB ( – ), sau 2 tháng điều trị Open AFB ( + ) ,
○ lao ngoài phổi Open thêm lao phổi AFB ( + ) sau 2 tháng điều trị ,
○ vi trùng đa kháng thuốc được xác lập trong bất kể thời gian nào trong quy trình điều trị với thuốc chống lao hàng 1 .
– Điều trị lại sau bỏ trị: người bệnh không dùng thuốc liên tục từ 2 tháng trở lên trong quá trình điều trị, sau đó quay trở lại điều trị với kết quả AFB(+) hoặc có bằng chứng vi khuẩn.
– Khác:
+ Lao phổi AFB ( + ) khác : là người bệnh đã điều trị thuốc lao trước kia với thời hạn lê dài trên 1 tháng nhưng không xác lập được phác đồ và hiệu quả điều trị hoặc không rõ tiền sử điều trị, nay chẩn đoán là lao phổi AFB ( + ) .
+ Lao phổi AFB ( – ) và lao ngoài phổi khác : Là người bệnh đã điều trị thuốc lao trước kia với thời hạn lê dài trên 1 tháng nhưng không xác lập được phác đồ và hiệu quả điều trị hoặc được điều trị theo phác đồ với nhìn nhận là hoàn thành xong điều trị, hoặc không rõ tiền sử điều trị, nay được chẩn đoán lao phổi AFB ( – ) hoặc lao ngoài phổi .
– Chuyển đến: người bệnh được chuyển từ đơn vị điều trị khác đến để tiếp tục điều trị (lưu ý: những bệnh nhân này không thống kê trong báo cáo “Tình hình thu nhận bệnh nhân lao” và “Báo cáo kết quả điều trị lao”, nhưng phải phản hồi kết quả điều trị cuối cùng cho đơn vị chuyển đi).
7.5. Phân loại bệnh nhân theo tình trạng nhiễm HIV
– Bệnh nhân lao/HIV(+): Bệnh nhân lao có kết quả xét nghiệm HIV(+).
– Bệnh nhân lao/HIV(-): Bệnh nhân lao có kết quả xét nghiệm HIV(-), các bệnh nhân lúc đầu kết quả HIV(-) nhưng sau đó xét nghiệm lại có kết quả HIV dương tính cần được phân loại lại.
– Bệnh nhân lao không rõ tình trạng HIV: Bệnh nhân lao không có kết quả xét nghiệm HIV, những bệnh nhân này sau khi có kết quả xét nghiệm HIV cần được phân loại lại.
7.6. Phân loại bệnh nhân dựa trên tình trạng kháng thuốc
Dựa theo phân loại của Tổ chức Y tế quốc tế và những phân loại này không loại trừ lẫn nhau :
– Kháng đơn thuốc: Chỉ kháng với duy nhất một thuốc chống lao hàng một khác Rifampicin
– Kháng nhiều thuốc: Kháng với từ hai thuốc chống lao hàng một trở lên mà không kháng với Rifampicin
– Lao kháng Rifampicin: Kháng với Rifampicin, có hoặc không kháng thêm với các thuốc lao khác kèm theo (có thể là kháng đơn thuốc, kháng nhiều thuốc, đa kháng thuốc hoặc siêu kháng thuốc).
– Đa kháng thuốc (MDR-TB): Kháng đồng thời với ít nhất hai thuốc chống lao là Isoniazid và Rifampicin.
– Tiền siêu kháng: Lao đa kháng có kháng thêm với hoặc bất cứ thuốc nào thuộc nhóm Fluoroquinolone hoặc với ít nhất một trong ba thuốc tiêm hàng hai (Capreomycin, Kanamycin, Amikacin, chứ không đồng thời cả 2 loại thêm).
– Siêu kháng thuốc (XDR-TB): Lao đa kháng có kháng thêm với bất cứ thuốc nào thuộc nhóm Fluoroquinolone và với ít nhất một trong ba thuốc tiêm hàng hai (Capreomycin, Kanamycin, Amikacin).
7.6.1. Phân loại bệnh nhân lao đa kháng theo tiền sử điều trị
– Lao đa kháng mới: bệnh nhân lao đa kháng chưa có tiền sử điều trị lao hoặc mới điều trị lao dưới 1 tháng (còn có thể gọi là lao đa kháng nguyên phát).
– Tái phát: là bệnh nhân đã có tiền sử điều trị lao trước đây, được kết luận khỏi bệnh hay hoàn thành điều trị, nay được chẩn đoán là lao đa kháng.
– Thất bại công thức I: bệnh nhân lao đa kháng có tiền sử là bệnh nhân lao thất bại điều trị công thức I trước đây.
– Thất bại công thức II: bệnh nhân lao đa kháng có tiền sử là bệnh nhân lao thất bại điều trị công thức II trước đây.
– Điều trị lại sau bỏ trị: là bệnh nhân đã có tiền sử điều trị lao trước đây, được kết luận là bỏ trị, nay được chẩn đoán là lao đa kháng.
– Lao đa kháng khác: là bệnh nhân lao đa kháng không rõ kết quả điều trị trước đây.
7.6.2. Phân loại bệnh nhân lao đa kháng theo xét nghiệm trước điều trị
– S+, C+: bệnh nhân lao đa kháng có xét nghiệm trước điều trị nhuộm soi trực tiếp dương tính, nuôi cấy dương tính.
– S-, C+: bệnh nhân lao đa kháng có xét nghiệm trước điều trị nhuộm soi trực tiếp âm tính, nuôi cấy dương tính.
– S+, C-: bệnh nhân lao đa kháng có xét nghiệm trước điều trị nhuộm soi trực tiếp dương tính, nuôi cấy âm tính.
7.7. Phân loại bệnh nhân lao theo tiền sử điều trị (theo phân loại mới của TCYTTG)
– Lao mới : người bệnh chưa khi nào dùng thuốc chống lao hoặc mới dùng thuốc chống lao dưới 1 tháng .
– Bệnh nhân điều trị lại : là người bệnh đã dùng thuốc chống lao từ 1 tháng trở lên. Bệnh nhân điều trị lại gồm có :
+ Tái phát : người bệnh đã được điều trị lao trước đây và được xác lập là khỏi bệnh, hay triển khai xong điều trị ở lần điều trị gần đây nhất, nay được chẩn đoán là mắc lao trở lại .
+ Thất bại : người bệnh đã được điều trị lao trước đây và được xác lập thất bại điều trị ở lần điều trị gần đây nhất .
+ Điều trị lại sau bỏ trị : người bệnh đã điều trị lao trước đây và được xác lập bỏ trị ở lần điều trị gần đây nhất .
+ Điều trị lại khác : những trường hợp đã từng điều trị lao trước đây nhưng không xác lập được hiệu quả điều trị .
– Bệnh nhân không rõ về tiền sử điều trị: là các bệnh nhân không rõ tiền sử điều trị, không thể xếp vào một trong các loại trên.
8. LỘ TRÌNH SỬ DỤNG XPERT MTB/RIF TRONG CHẨN ĐOÁN LAO VÀ LAO KHÁNG THUỐC
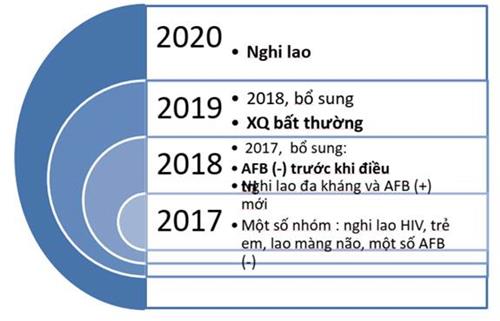
Song song với việc chẩn đoán kháng thuốc, Xpert MTB / RIF còn được sử dụng để chẩn đoán bệnh lao trên một số ít nhóm đối tượng người dùng đặc biệt quan trọng. Lộ trình lan rộng ra những nhóm đối tượng người dùng được xét nghiệm Xpert MTB / RIF dự kiến sẽ tiến hành trong Chương trình Chống lao Quốc gia từ 2017 như sau :
Năm 2017 :
– Chẩn đoán kháng thuốc trên nhóm nghi lao kháng thuốc và người bệnh lao phổi AFB (+) mới (8 nhóm nêu trên)
– Chẩn đoán lao trên một số nhóm đối tượng đặc biệt bao gồm: Người nghi lao có HIV (+), trẻ em nghi lao, người nghi lao màng não, AFB (-) ở một số địa phương
Năm 2018 : Tiếp tục tiến hành trên những nhóm đối tượng người tiêu dùng đã triển khai 2017, ngoài những bổ trợ :
– Xét nghiệm Xpert MTB/RIF trước khi điều trị cho người bệnh đã được chẩn đoán lao phổi AFB (-). Lưu ý: Xpert MTB/RIF có giá trị cung cấp thêm bằng chứng vi khuẩn trong chẩn đoán bệnh lao. Trường hợp xét nghiệm Xpert cho kết quả không có bằng chứng vi khuẩn lao cũng không loại trừ bệnh lao trong trường hợp đã được chẩn đoán lao phổi AFB (-).
Năm 2019 : Bổ sung và lan rộng ra chẩn đoán lao phổi :
Xét nghiệm Xpert MTB / RIF cho những trường hợp có hình ảnh XQ không bình thường nghi lao .
Từ năm 2020 : Bổ sung và lan rộng ra chẩn đoán bệnh lao :
– Mở rộng tới mọi đối tượng biểu hiện nghi lao (Tùy nguồn lực)
XÉT NGHIỆM AFB NHUỘM SOI TRỰC TIẾP
PHƯƠNG PHÁP NHUỘM ZIEHL – NEELSEN
1. MỤC ĐÍCH
Kỹ thuật này nhằm mục đích xác lập vi trùng kháng cồn kháng toan AFB ( Acid-Fast – Bacilli ) bằng giải pháp nhuộm Ziehl-Neelsen ( ZN ) sử dụng kính hiển vi quang học .
2. BỆNH PHẨM
2.1. Loại bệnh phẩm
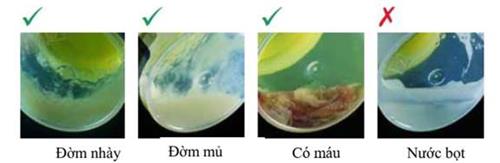
– Bệnh phẩm đờm đạt chất lượng: có nhày mủ, thể tích mẫu ít nhất 2 ml.
– Cặn bệnh phẩm sau ly tâm.
– Khuẩn lạc mọc trên môi trường đặc.
– Canh khuẩn từ týp MGIT (+).
2.2. Yêu cầu về hành chính
– Mẫu phải đựng trong cốc/týp theo qui định.
– Mẫu phải đầy đủ thông tin trên thân dụng cụ chứa mẫu.
– Phiếu xét nghiệm (XN) phải đủ thông tin người bệnh.
– Thông tin trên mẫu và phiếu xét nghiệm phải phù hợp.
3. TRANG THIẾT BỊ – VẬT LIỆU
3.1. Thiết bị
– Tủ an toàn sinh học cấp I được kiểm chuẩn hàng năm.
– Đèn gas hoặc đèn cồn để cố định tiêu bản.
– Máy làm khô tiêu bản (ở nơi có số lượng mẫu nhiều trong ngày).
– Bồn nhuộm tiêu bản.
– Đồng hồ phút.
– Kính hiển vi quang học 2 mắt với vật kính 100X, 10X.
– Nồi hấp hoặc lò đốt.
– Thùng rác có nắp đậy.
3.2. Vật liệu
– Lam kính có đầu mờ.
– Bút chì đen HB.
– Que phết đờm dùng 1 lần (tre, gỗ).
– Vòi nước.
– Bộ hóa chất nhuộm ZN.
– Que có đầu bông (gạc) để đốt lửa hơ nóng tiêu bản.
– Giá nhuộm tiêu bản.
– Giấy lau kính.
– Hộp đựng tiêu bản.
– Giá để tiêu bản sau khi dàn, giá để tiêu bản sau khi nhuộm.
– Giấy lọc thuốc nhuộm.
– Dụng cụ và túi nilon chứa chất thải.
– Dầu soi kính.
4. HÓA CHẤT
4.1. Chuẩn bị hóa chất nhuộm ZN
4.1.1. Dung dịch nhuộm màu Ziehl’s Carbol Fuchsin 0,3%
– Công thức :
Phenol tinh thể … … … … … … … … … … … 50 gam
Cồn Ethylic 95 ° … … … … … … … ………. 100 ml
Fuchsin basis … … … … … … … … … … … … 3 gam
Nước cất … … … … … … … … … … … … .. 850 ml
– Cách pha : hòa tan phenol trong 100 ml cồn, thêm 3 g Fuchsin hòa tan, lọc hỗn dịch trên vào 850 ml nước cất, lắc đều .
4.1.2. Dung dịch tẩy màu cồn acid HCl 3%
– Công thức :
Acid HCl đậm đặc … … … … … … … … … … 30 ml
Cồn Ethylic 95 ° … … … … … … … … … … .. 970 ml
– Cách pha : cho từ từ acid đậm đặc vào chai chứa 970 cồn. Không làm ngược lại vì gây nổ .
4.1.3. Dung dịch nhuộm nền xanh methylen 0,3%
– Công thức :
Methylen blue … … … … … … … … … … … … 3 gam
Nước cất … … … … … … … … … … … … … 1000 ml .
– Cách pha : hòa tan 3 g Methylen blue trong 1000 ml nước cất .
4.2. Bảo quản và hạn sử dụng
– Tuyến tỉnh pha hóa chất nhuộm ZN, lọc và kiểm tra chất lượng đạt yêu cầu, cấp cho tuyến huyện theo chu kỳ hàng tháng.
– Hóa chất màu của ZN phải được bảo quản trong chai thủy tinh màu.
– Bộ hóa chất nhuộm ZN và bộ chai bảo quản thuốc nhuộm phải dán nhãn ghi tên hóa chất, nồng độ, ngày pha và hạn sử dụng.
– Bảo quản hóa chất ở nơi thoáng mát, tránh ánh nắng mặt trời.
– Khi thay hóa chất mới, phải rửa sạch chai cũ tránh tạo cặn fuchsin gây lỗi sai dương.
5. NGUYÊN LÝ
Mycobacteria ( trong đó có vi trùng lao ) có lớp vách sáp dày nên khó bắt màu với thuốc nhuộm thường thì và có tính kháng cồn – acid. Phương pháp nhuộm Ziehl do thuốc nhuộm có chứa phenol và hơ nóng khi nhuộm nên fuchsin ngấm qua lớp vách của vi trùng, khi tẩy màu bằng dung dịch cồn-acid 3 %, AFB vẫn giữ được màu đỏ Fuchsin trong khi những tế bào và vi trùng khác bị tẩy mất màu đỏ, bước nhuộm nền tạo sự tương phản giữa AFB màu đỏ trên màu nền xanh sáng .
6. CÁC BƯỚC THỰC HIỆN
6.1. Chuẩn bị
– Sử dụng lam kính mới, không có vết xước hoặc mốc, đã lau cồn 95° và làm khô.
– Cập nhật thông tin bệnh nhân vào sổ xét nghiệm trước khi thực hiện kỹ thuật.
– Số xét nghiệm thống nhất từ sổ xét nghiệm, phiếu xét nghiệm, cốc đờm và lam kính. Số xét nghiệm gồm 2 phần: tử số là số thứ tự trong sổ xét nghiệm, mẫu số là số thứ tự của mẫu (Ví dụ: 120/1, 120/2). Đối chiếu và kiểm tra các thông tin cẩn thận tránh nhầm lẫn. Số xét nghiệm theo thứ tự từ đầu năm đến cuối năm.
– Dùng bút chì đen HB viết số xét nghiệm lên đầu mờ của lam kính. Không chạm tay vào phần lam kính còn lại.
– Sắp xếp cốc đờm và lam kính theo thứ tự tránh nhầm lẫn.
– Khởi động tủ ATSH trước khi sử dụng ít nhất 15 phút để thanh lọc khí.
– Sắp xếp dụng cụ/vật liệu cần thiết vào tủ ATSH: máy làm khô tiêu bản (bật máy ở 50°-60°C), que dàn tiêu bản, bô can chứa chất sát khuẩn, giá đựng tiêu bản, khay có lót khăn, giấy thấm dung dịch sát khuẩn, lam kính và cốc đờm.
6.2. Dàn tiêu bản
6.2.1. Bệnh phẩm đờm
– Mở nắp cốc đờm nhẹ nhàng, đặt nắp ngửa trên khay.
– Quan sát kỹ mẫu đờm, dùng đầu vát của que phết đờm chọn mảnh đờm nhày mủ, nhẹ nhàng cắt mẩu đờm bằng cách di cạnh vát que tre vào thành cốc đờm.
– Đặt mẩu đờm lên giữa lam kính trùng số với cốc đờm, dùng mặt vát que tre dàn đờm trên lam theo hình bầu dục kích thước 1x2cm, quay mũi nhọn que tre dàn tiếp tạo độ mịn cho vết dàn. Dàn đờm đều đặn, liên tục theo hình xoắn ốc từ trung tâm ra ngoài hoặc theo kiểu tóc rối, dàn đến khi thấy đờm hơi se. Không dàn khi đờm đã khô.
– Hủy que phết đờm vào bô can có chất sát khuẩn.
– Đặt tiêu bản lên giá để khô tự nhiên hoặc làm khô trên máy làm khô tiêu bản.
– Đậy lại nắp cốc đờm.
Sử dụng que tre có đầu vát theo hình ảnh
6.2.2. Cặn bệnh phẩm sau li tâm
– Nhỏ 1 – 2 giọt cặn lên giữa lam kính, dàn tiêu bản theo kích thước 1 x 2 cm.
– Các bước tiếp theo giống như tiêu bản đờm.
6.2.3. Canh khuẩn MGIT (+)
– Quan sát tuýp MGIT (+) nếu có cặn vụn ở đáy tuýp, dùng pipet nhựa vô trùng hút nhẹ lớp cặn vụn nhỏ 1 giọt vào lam kính đã tạo nền albumin, dàn nhẹ nhàng.
– Nếu canh khuẩn đục đều hút 1 – 2 giọt làm tiêu bản.
– Các bước tiếp theo giống như tiêu bản đờm.
6.2.4. Khuẩn lạc từ nuôi cấy đặc
– Lấy khuẩn lạc từ tuýp cấy nghiền nhẹ vào 1 giọt nước cất trên lam kính tạo huyền dịch hơi đục, dàn tiêu bản.
– Các bước tiếp theo giống như tiêu bản đờm.
6.3. Cố định tiêu bản
Hơ nóng tiêu bản qua ngọn lửa đèn cồn 3 lần mỗi lần khoảng chừng 3 giây ( mặt tiêu bản ngửa lên trên ) .
6.4. Nhuộm tiêu bản: 3 bước
6.4.1 Nhuộm màu
– Xếp tiêu bản theo thứ tự trên giá nhuộm, mỗi tiêu bản cách nhau ít nhất 1 cm.
– Phủ dung dịch Fuchsin 0,3% kín toàn bộ bề mặt lam kính.
– Hơ nóng tiêu bản từ phía dưới đến khi Fuchsin bốc hơi.
– Để ít nhất 5 phút.
– Nếu Fuchsin tràn ra ngoài, bổ sung thêm Fuchsin và hơ nóng lại.
– Rửa tiêu bản nhẹ nhàng cho trôi hết thuốc nhuộm.
– Nghiêng tiêu bản cho ráo nước.
6.4.2 Tẩy màu
– Phủ đầy dung dịch acid – cồn lên tiêu bản, để 3 phút.
– Rửa nước. Nghiêng tiêu bản cho ráo nước.
– Sau khi rửa, các tiêu bản không còn màu hồng.
– Nếu tiêu bản vẫn còn màu hồng, tẩy lại lần 2, thời gian từ 1- 3 phút cho đến khi hết màu hồng, rửa lại nước.
6.4.3 Nhuộm nền
– Phủ đầy dung dịch xanh Methylene 0,3% lên tiêu bản.
– Để 30 giây – 1 phút.
– Rửa nước, nghiêng tiêu bản cho ráo nước.
Chú ý: cho vòi nước chảy nhẹ nhàng từ đầu tiêu bản. KHÔNG xối vòi nước thẳng vào vết dàn.
6.5. Làm khô tiêu bản
– Xếp tiêu bản lên giá để khô tự nhiên, hoặc bằng máy làm khô tiêu bản.
Chú ý: KHÔNG làm khô tiêu bản bằng cách hơ tiêu bản qua ngọn lửa hay dùng khăn hoặc giấy để thấm khô.
6.6. Soi kính hiển vi
6.6.1 Lấy vi trường
– Bật nguồn điện.
– Lau thị kính, vật kính và tụ quang bằng giấy lau chuyên dụng.
– Xoay vật kính x10 vào trục quang học.
– Đặt tiêu bản lên mâm kính, sử dụng vật kính x10 để lấy vi trường.
– Nhỏ một giọt dầu soi vào đầu trái của vết dàn, để giọt dầu rơi tự do không chạm đầu ống nhỏ giọt vào vết dàn tránh nhiễm chéo.
– Xoay vật kính x100 vào trục quang học. Dầu soi tạo thành 1 lớp mỏng giữa vật kính x100 và tiêu bản.
– Không để vật kính chạm tiêu bản.
– Điều chỉnh ốc vi cấp nhẹ nhàng để nhìn hình ảnh rõ nét.
Chú ý: Không soi tiêu bản ướt vì không rõ vi trường và có thể hỏng vật kính
Chỉ dùng ốc vi cấp với vật kính x100 .
6.6.2. Cách soi tiêu bản và nhận định kết quả
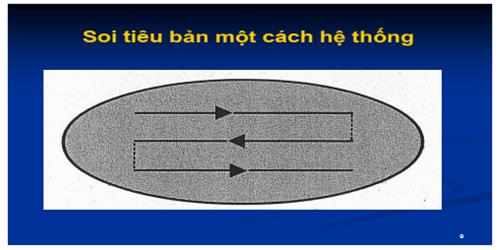
– Cách soi: cần phải hệ thống và chuẩn hóa, soi dòng giữa từ trái sang phải (tương đương với 100 vi trường). Điều chỉnh ốc vi cấp cho hình ảnh rõ nét nhất, quan sát kỹ từ ngoại vi vào trung tâm vi trường để phát hiện AFB. Đọc xong vi trường thứ nhất, chuyển sang đọc các vi trường kế tiếp cho đến hết dòng. Khi cần đọc > 100 vi trường, chuyển dòng kế tiếp từ phải qua trái (theo hình vẽ).
– Nhận định kết quả:
+ Hình ảnh AFB từ bệnh phẩm : AFB có hình que mảnh, hơi cong, bắt màu đỏ, đứng riêng không liên quan gì đến nhau hay xếp thành từng cụm, dễ nhận ra trên nền xanh. Đếm số lượng AFB và ghi hiệu quả theo lao lý như bảng 1 .
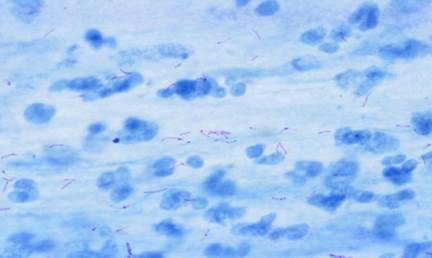
Bảng 1: Quy định ghi kết quả xét nghiệm AFB nhuộm ZN
|
Số lượng AFB |
Kết quả |
Phân loại |
| 0 AFB / 100 vi trường | Âm tính | |
| 1 – 9 AFB / 100 vi trường | Dương tính | Ghi số lượng AFB đơn cử |
| 10 – 99 AFB / 100 vi trường | Dương tính | 1 + |
|
1 – 10 AFB / 1 vi trường ( soi tối thiểu 50 vi trường ) |
Dương tính | 2 + |
|
> 10 AFB / 1 vi trường ( soi tối thiểu 20 vi trường ) |
Dương tính | 3 + |
+ Hình ảnh AFB từ khuẩn lạc trên nuôi cấy đặc : AFB màu đỏ xếp thành đám sum sê hoặc thành từng búi lớn .
+ Hình ảnh AFB từ tuýp MGIT ( + ) : AFB màu đỏ kết thành cuộn thừng ( cord forming ) hoặc thành đám hoặc rải rác riêng không liên quan gì đến nhau .
6.6.3. Lưu trữ tiêu bản
– Không ghi kết quả soi trên tiêu bản.
– Các tiêu bản sau khi soi xong, làm sạch dầu soi bằng cách xếp tiêu bản vào hộp bảo quản có lót giấy mềm để thấm dầu soi chảy xuống. Hôm sau, lau phần dầu soi còn đọng lại ở cạnh tiêu bản.
– Xếp các tiêu bản vào hộp đựng tiêu bản theo thứ tự trong sổ xét nghiệm để phục vụ cho công tác kiểm định tiêu bản.
– Hộp tiêu bản lưu ở nơi thoáng, khô ráo và tránh ánh nắng trực tiếp.
7. GHI CHÉP VÀ BÁO CÁO KẾT QUẢ
– Kiểm tra số XN trên tiêu bản trùng với số ghi trên phiếu XN.
– Ghi kết quả soi kính vào phần xét nghiệm của phiếu XN và sổ xét nghiệm.
– Ghi ngày tháng làm XN và ký tên vào phiếu và sổ xét nghiệm.
– Kết quả dương tính phải ghi bằng mực đỏ trong sổ xét nghiệm.
– Thực hiện báo cáo tháng, báo cáo quý và báo cáo năm theo qui định của CTCLQG.
8. KIỂM TRA CHẤT LƯỢNG
8.1. Kiểm tra chất lượng thuốc nhuộm
– Kiểm tra chất lượng thuốc nhuộm ngay sau khi pha lô mới:
+ Chuẩn bị sẵn lô tiêu bản từ mẫu đờm biết trước hiệu quả âm tính và dương thế ở mức độ 1 + .
+ Mỗi lô thuốc nhuộm mới pha nhuộm 3 tiêu bản dương và 3 tiêu bản âm đúng tiến trình kĩ thuật .
+ Kết quả thuốc nhuộm đạt chất lượng : tiêu bản dương thấy AFB bắt màu đỏ trên nền xanh sáng, không thấy cặn thuốc nhuộm, tiêu bản âm không thấy AFB .
+ Kết quả thuốc nhuộm không đạt chất lượng : tiêu bản dương không thấy AFB hoặc AFB nhạt màu, nền xanh tối, thấy cặn thuốc nhuộm, tiêu bản âm thấy AFB .
+ Kiểm tra chất lượng nhuộm tiêu bản hàng ngày : nhuộm chứng dương và âm cùng mẻ nhuộm tiêu bản thường thì. Đọc hiệu quả chứng dương và chứng âm trước khi đọc tiêu bản của người bệnh .
+ Khi tác dụng kiểm tra không đạt, phải xem xét lại hàng loạt quy trình từ thuốc nhuộm, tiêu bản chứng đến kỹ thuật nhuộm soi, nhuộm thêm lô tiêu bản chứng mới nếu hiệu quả vẫn không đạt phải hủy bỏ thuốc nhuộm .
– Chỉ sử dụng và cấp phát thuốc nhuộm đã kiểm tra đảm bảo chất lượng.
– Phải có sổ pha, kiểm tra, quản lý và cấp phát thuốc nhuộm.
– Hạn sử dụng thuốc nhuộm 1 tháng theo qui định của CTCLQG.
– Chai lọ đựng thuốc nhuộm phải được dán nhãn và hạn sử dụng, được bảo quản nơi thoáng mát, khô ráo và tránh ánh nắng mặt trời.
8.2. Kiểm tra chất lượng tiêu bản theo 6 tiêu chuẩn
8.2.1. Chất lượng bệnh phẩm
– Sự có mặt của bạch cầu đa nhân, đại thực bào.
– Chất lượng bệnh phẩm đạt yêu cầu khi soi:
+ Có trên 25 bạch cầu đa nhân / 1VT ở độ phóng đại 100 x ( vật kính 10 x, thị kính 10 x ) hay 3-4 bạch cầu đa nhân / 1VT với vật kính dầu .
+ Hoặc có đại thực bào .
– Bệnh phẩm đạt chất lượng kết quả xét nghiệm mới chính xác.
8.2.2. Kích thước tiêu bản
– Kích thước 1x2cm, cú hình ovan nằm ở giữa lam kính
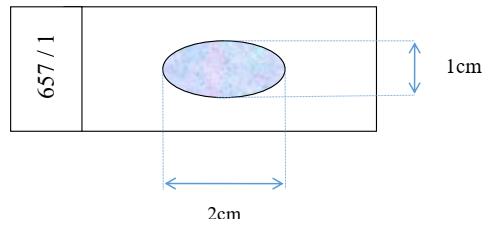
8.2.3. Độ mịn
– Bệnh phẩm được dàn đều để đạt độ mịn cần thiết.
– Tiêu bản đạt về độ mịn:
+ Bề mặt tiêu bản liên tục, đều đặn, không bị rỗng, bong trụi .
+ Soi kính : những vi trường liên tục không có nhiều vi trường rỗng, độ sáng đều đặn .
8.2.4. Độ dày
– Tiêu bản đạt tiêu chuẩn có độ dày khoảng 0,04 mm, khi tiêu bản khô, chưa nhuộm có thể kiểm tra bằng cách để một tờ giấy có chữ in xuống dưới tiêu bản cách 4-5 cm nếu nhìn thấy chữ mờ có thể đọc được là đạt, không đọc được chữ là dày, nhìn chữ quá rõ là mỏng.
Quá mỏng dính Đạt độ dày Quá dày
– Nếu quá dày tiêu bản có nhiều lớp, không soi thấu, vi trường xanh tối; nếu quá mỏng các vi trường thưa thớt, nền xanh nhạt.
8.2.5. Nhuộm và tẩy màu
– Tiêu bản nhuộm và tẩy màu đạt: AFB bắt mầu đỏ phân biệt rõ ràng với nền màu xanh
– Tiêu bản nhuộm và tẩy màu không đạt:
+ AFB nhạt mầu hoàn toàn có thể do tẩy quá hoặc nhuộm chưa đủ ( thời hạn, sức nóng … ) .
+ Nền cũng màu đỏ do tẩy màu chưa đủ khó phân biệt rõ AFB ( những tiêu bản nhìn bằng mắt thường còn màu đỏ là tẩy chưa đạt ) .
+ Nền xanh đậm, AFB tối do nhuộm nền quá lâu .
8.2.6. Độ sạch
– Tiêu bản đạt độ sạch: soi không thấy các cặn bẩn, cặn Fuchsin, tinh thể..
– Tiêu bản không đạt độ sạch: soi thấy các cặn bẩn, cặn Fuchsin, tinh thể.. do thuốc nhuộm cú cặn hoặc do hơ quá nóng trong khi nhuộm Fuchsin.
8.3. Kiểm định tiêu bản
– Thực hiện kiểm định tiêu bản theo phương pháp kiểm định theo lô (LQAS)
– PXN tuyến tỉnh thực hiện kiểm định tiêu bản hàng tháng cho tuyến huyện.
– PXN tuyến trung ương kiểm định cho tuyến tỉnh hàng quí hoặc kiểm tra ngẫu nhiên trong các đợt KTGS quí.
8.4. Đọc sai kết quả – Hậu quả – Cách phòng ngừa
8.4.1.Hậu quả lỗi sai dương
– Người bệnh “bị” điều trị một cách không cần thiết.
– Đánh giá sai kết quả, tăng tỉ lệ bệnh nhân lao.
– Lãng phí thuốc.
– Người bệnh không tin tưởng vào xét nghiệm.
8.4.2. Phòng ngừa lỗi sai dương
– Chất lượng kính hiển vi tốt.
– Sử dụng tiêu bản mới, không có vết xước.
– Sử dụng que phết đờm riêng cho từng bệnh phẩm.
– Hóa chất nhuộm Ziehl đạt chất lượng.
– Không để dung dịch Fuchsin khô trong khi nhuộm.
– Không có thức ăn hoặc chất xơ trong mẫu đờm.
– Lau vật kính dầu sau mỗi lần soi tiêu bản dương.
– Đối chiếu số xét nghiệm chính xác, thông tin bệnh nhân phù hợp.
– Ghi chép và báo cáo kết quả chính xác.
8.4.3. Hậu quả của lỗi sai âm
– Người bệnh lao không được điều trị có thể tử vong.
– Người bệnh tiếp tục truyền bệnh cho những người xung quanh.
– Đánh giá kết quả điều trị sai lệch.
– Người bệnh không tin tưởng vào xét nghiệm.
8.4.4. Phòng ngừa lỗi sai âm
– Chất lượng kính hiển vi tốt.
– Đảm bảo đờm đạt chất lượng (ít nhất 2 ml, có nhày mủ).
– Hóa chất nhuộm Ziehl đạt chất lượng.
– Thực hiện đúng qui trình kĩ thuật: chọn mảnh đờm đặc, mủ để làm tiêu bản, dàn tiêu bản đạt độ dày, cố định tiêu bản tốt, nhuộm fuchsin đủ độ nóng và đủ thời gian.
– Phải đọc đủ 100 vi trường.
– Đối chiếu số xét nghiệm chính xác, thông tin bệnh nhân phù hợp.
– Ghi chép và báo cáo kết quả chính xác.
8.5. Các vấn đề phát sinh khi soi kính và cách giải quyết
|
Vấn đề |
Nguyên nhân |
Giải pháp |
| Độ sáng của vi trường không đạt |
– Tụ quang để quá thấp – Tụ quang bị đóng |
– Nâng tụ quang lên – Mở chắn sáng ra |
| Bóng tối trong vi trường hoạt động khi xoay thị kính |
– Thị kính bị bẩn – Bề mặt của thị kính bị xước |
– Lau sạch thị kính – Thay thị kính mới |
| Hình ảnh không rõ khi soi vật kính dầu |
– Mặt tiêu bản bị lật ngược – Có bọt khí trong dầu – Chất lượng dầu soi kém – Vật kính bị bẩn |
– Lật tiêu bản lên – Di chuyển vật kính x 100 nhanh từ bên này sang bên kia – Chỉ sử dụng dầu soi chất lượng tốt . – Lau sạch vật kính |
| Hình ảnh không rõ khi soi vật kính độ phóng đại nhỏ |
– Có dầu ở vật kính – Có lớp bụi trên mặt phẳng của vật kính – Vật kính hoàn toàn có thể bị vỡ |
– Lau sạch vật kính – Thay vật kính mới |
8.6. Bảo quản kính hiển vi
– Đặt KHV ở nơi vững chắc, khô ráo, không có bụi, tránh ánh nắng trực tiếp. Độ ẩm cao có thể làm mốc bộ phận quang học (vật kính, thị kính, tụ quang..) và bộ phận cơ học bị han rỉ.
– Tránh va chạm mạnh làm hỏng kính hiển vi, không để vật kính chạm vào tiêu bản
– Chỉ sử dụng ốc vi cấp khi soi vật kính dầu
– Lau bộ phận quang học bằng giấy lau chuyên dụng, lau sạch dầu soi trên bề mặt vật kính dầu ngay sau khi sử dụng
– Vệ sinh kính sau mỗi ngày sử dụng.
– Khi không sử dụng để kính ở trạng thái “nghỉ”: tắt nguồn điện, xoay vật kính ra khỏi trục quang học, hạ tụ quang, phủ kính tránh bụi.
– Nếu có điều kiện bảo quản KHV trong tủ bảo quản kính chuyên dụng.
– Nếu phát hiện kính bị hỏng tuyệt đối không được tự ý tháo ra sửa chữa phải báo người có trách nhiệm giải quyết.
9. THỰC HÀNH AN TOÀN PXN
– Sắp xếp bố trí phòng xét nghiệm nhuộm soi trực tiếp hợp lý.
– Sử dụng tủ ATSH theo qui định, đảm bảo luồng khí lưu thông trong tủ không bị ảnh hưởng bởi các vật liệu che lấp. Kết thúc công việc, lau tủ bằng cồn 70°.
– Các thao tác kỹ thuật phải nhẹ nhàng tránh tạo hạt mù: mở nắp lọ đờm, lấy mảnh đờm, dàn tiêu bản., cố định khi tiêu bản chưa khô hoàn toàn.
– Khử nhiễm vật liệu lây nhiễm theo qui định.
XÉT NGHIỆM AFB NHUỘM SOI TRỰC TIẾP PHƯƠNG PHÁP NHUỘM HUỲNH QUANG ĐÈN LED
1. MỤC ĐÍCH
Kỹ thuật này nhằm mục đích xác lập vi trùng kháng cồn kháng toan AFB ( Acid – Fast – Bacilli ) bằng giải pháp nhuộm huỳnh quang sử dụng kính huỳnh quang đèn LED .
2. BỆNH PHẨM
Đờm và cặn bệnh phẩm sau li tâm ( không nhuộm huỳnh quang chủng vi trùng ) .
3. TRANG THIẾT BỊ VÀ VẬT LIỆU
Giống chiêu thức nhuộm Ziehl – Neelsen. Thay thế KHV quang học bằng KHV huỳnh quang đèn LED .
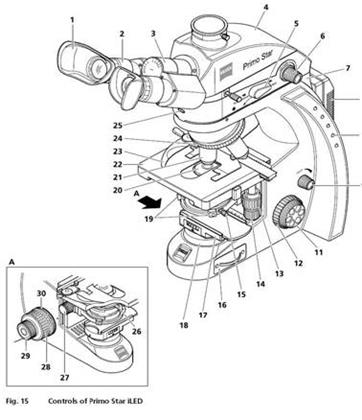
– Cấu tạo KHV đèn LED: 30 phần
1. Diềm thị kính ( hoàn toàn có thể tháo ra nếu người sử dụng cảm thấy không thuận tiện ) .
2. Thị kính .
3. Ống gắn thị kính .
4. Ống chứa mạng lưới hệ thống lăng kính .
5. Cần quy đổi quang hệ ( quang hệ truyền qua / quang hệ phản xạ ) .
6. Nút bật / tắt và kiểm soát và điều chỉnh cường độ chiếu sáng cho quang hệ phản xạ .
7. Tay xách .
8. Bộ chuyển nguồn điện .
9. Cụm đèn báo cường độ chiếu sáng cho quang hệ truyền qua .
10. Nút bật / tắt và kiểm soát và điều chỉnh cường độ chiếu sáng cho quang hệ truyền qua .
11. Nút kiểm soát và điều chỉnh vi cấp ( bên phải ) .
12. Nút kiểm soát và điều chỉnh vĩ cấp ( bên phải ) .
13. Nút kiểm soát và điều chỉnh vận động và di chuyển mâm kính ( chiều trái – phải ) .
14. Nút kiểm soát và điều chỉnh vận động và di chuyển mâm kính ( chiều trước – sau ) .
15. Chốt cố định và thắt chặt tụ quang .
16. Nguồn chiếu sáng .
17. Gá phin lọc ánh sáng vàng .
18. Màn trập ( cố định và thắt chặt ) .
19. Cặp vít chỉnh tụ quang chính tâm .
20. Tụ quang .
21. Vật kính .
22. Mâm kính .
23. Cần kẹp lam kính .
24. Vòng xoay gắn vật kính .
25. Đèn báo nguồn chiếu sáng quang hệ phản xạ ( màu xanh dương : bật ; cường độ chiếu sáng tỷ suất thuận với độ chiếu sáng của đèn báo ) .
26. Cần kiểm soát và điều chỉnh màn chập của tụ quang .
27. Nút kiểm soát và điều chỉnh theo chiều thẳng đứng .
28. Nút kiểm soát và điều chỉnh vĩ cấp ( bên trái ) .
29. Nút kiểm soát và điều chỉnh vi cấp ( bên trái ) .
30. Vòng kiểm soát và điều chỉnh độ mượt khi vận động và di chuyển nút vĩ cấp .
– Các bước sử dụng kính hiển vi huỳnh quang đèn LED: 8 bước
Bước 1. Nối nguồn điện hoặc dùng pin. Đóng chắn sáng .
Bước 2. Lựa chọn ánh sáng huỳnh quang ( gạt nút ngược chiều kim đồng hồ đeo tay phía ” fluorescence ” ) ( công tắc nguồn số 5 ) .
Bước 3. Chỉnh nút on / of kiểm soát và điều chỉnh ánh sáng huỳnh quang ( số 6 ) .
Bước 4. Quan sát tiêu bản bằng vật kính 10 X, sử dụng vĩ cấp .
Bước 5. Điều chỉnh khoảng cách giữa 2 ống thị kính để có 1 hình ảnh trùng nhau .
Bước 6. Chỉnh vi cấp để có hình ảnh rõ nét .
Bước 7. Chuyển vật kính 20 X để quan sát tìm AFB .
Bước 8. Quan sát kỹ vi trường, sau đó chuyển vi trường khác theo chiều dài tiêu bản bằng nút vận động và di chuyển ( số 13, 14 ) .
Hình ảnh KHV huỳnh quang đèn LED
4. HÓA CHẤT NHUỘM HUỲNH QUANG
4.1 Hóa chất tự pha:
4.1.1. Dung dịch Auramine 0,1%
– Công thức:
+ Auramin O : 1 gam
+ Phenol : 30 gam
+ Cồn 95 % 100 ml
+ Nước cất 870 ml
– Cách pha
+ Hòa tan 30 gam phenol vào 100 ml cồn 95 °
+ Thêm 1 gam auramin O vào dung dịch trên ,
+ Trộn đều. Có thể sử dụng máy trộn ,
+ Cho nước cất vừa đủ 1000 ml ,
+ Lọc qua giấy lọc và chứa vào chai màu ,
+ Dán nhãn ghi rõ tên hóa chất, nồng độ, và ngày pha ,
+ Vặn chặt nút chai giữ trong tủ, tránh ánh sáng mặt trời .
+ Hạn sử dụng 1 tháng .
4.1.2. Dung dịch cồn tẩy acid HCl 0,5%
– Công thức:
+ Cồn 70 ° 995 ml
+ HCl 5 ml
– Cách pha:
+ Cho 995 ml cồn 70 ° vào bình 2 lít ,
+ Rót từ từ acid HCl vào bình, trộn đều ,
+ Dán nhãn ghi tên hóa chất, nồng độ và ngày pha ,
+ Vặn chặt nút chai giữ trong tủ, tránh ánh sáng mặt trời ,
+ Hạn sử dụng 1 tháng .
4.1.3. Dung dịch methylen blue 0,3%
– Công thức :
+ Methylene blue : 3 gam
+ Nước cất : 1000 ml
– Cách pha :
+ Hòa tan xanh methylen trong nước cất .
+ Dán nhãn ghi tên hóa chất, nồng độ và ngày pha .
+ Vặn chặt nút chai giữ trong tủ, tránh ánh sáng mặt trời .
+ Hạn sử dụng 1 tháng .
4.2. Hóa chất huỳnh quang nhanh (bô kít):
– QBC. FAST AuraminO : chai 250 ml màu nâu .
– QBC. FAST Decolerizer / Quencher : chai 250 ml màu xanh .
Bộ hóa chất trong hạn sử dụng .
5. NGUYÊN LÝ
Mycobacteria có lớp vách sáp dày, khi nhuộm Auramine thấm vào vi trùng do có phenol trong dung dịch nhuộm, khi tẩy màu bằng dung dịch acid-cồn AFB vẫn giữ được màu vàng của auramine do có tính kháng acid, nhuộm nền bằng xanh methylene để tạo màu nền tối, thuần nhất cho ánh sáng phát quang. Khi soi bằng ánh sáng huỳnh quang AFB phát quang màu vàng sáng tương phản rõ ràng trên nền tối .
Kính hiển vi huỳnh quang có ưu điểm là soi nhanh hơn KHV quang học ( ánh sáng trắng ) với nhuộm Ziehl – Neelsen và đặc biệt quan trọng có giá trị ở những phòng xét nghiệm có khối lượng việc làm lớn. Kĩ thuật này cũng có độ nhạy cao hơn ở những mẫu bệnh phẩm ít vi trùng vì số vi trường được quan sát nhiều hơn .
6. CÁC BƯỚC THỰC HIỆN
6.1. Chuẩn bị tiêu bản
Các bước làm tiêu bản, cố định và thắt chặt tiêu bản giống như giải pháp nhuộm ZN .
6.2. Các bước nhuộm huỳnh quang (hóa chất tự pha)
6.2.1. Nhuộm màu Auramine
– Xếp tiêu bản theo thứ tự trên giá nhuộm, mỗi tiêu bản cách nhau ít nhất 1 cm.
– Phủ dung dịch auramine 0,1 % kín toàn bộ bề mặt tiêu bản.
– Để ít nhất 15 phút.
– Rửa tiêu bản nhẹ nhàng cho trôi hết thuốc nhuộm.
– Nghiêng tiêu bản cho ráo nước.
6.2.2 Tẩy màu
– Phủ đầy dung dịch acid – cồn 0,5% lên tiêu bản, để 2 phút.
– Rửa nước. Nghiêng tiêu bản cho ráo nước.
– Sau khi rửa, các tiêu bản không còn màu vàng.
– Nếu tiêu bản vẫn còn màu vàng, tẩy lại lần 2, thời gian từ 1 – 2 phút cho đến khi hết màu vàng, rửa lại nước.
6.2.3. Nhuộm nền
– Phủ đầy dung dịch xanh Methylene 0,3% lên tiêu bản.
– Để 1 – 2 phút.
– Rửa nước, nghiêng tiêu bản cho ráo nước.
6.2.4. Làm khô tiêu bản
– Để tiêu bản khô tự nhiên ở nhiệt độ PXN hoặc làm khô ở máy làm khô tiêu bản.
– Xếp tiêu bản vào hộp tránh ánh sáng.
6.3. Các bước nhuộm huỳnh quang nhanh (bộ kit QBC)
6.3.1. Nhuộm màu Auramine
– Xếp tiêu bản theo thứ tự trên giá nhuộm, mỗi tiêu bản cách nhau ít nhất 1 cm.
– Phủ dung dịch FAST AuraminO kín vết dàn.
– Để 1-2 phút.
– Rửa tiêu bản nhẹ nhàng cho trôi hết thuốc nhuộm.
– Nghiêng tiêu bản cho ráo nước.
6.3.2. Tẩy màu và nhuộm nền
– Phủ dung dịch FAST Decolerizer/Quencher kín vết dàn.
– Để 1 phút.
– Rửa nước. Nghiêng tiêu bản cho ráo nước.
– Để tiêu bản khô tự nhiên ở nhiệt độ PXN hoặc làm khô ở máy làm khô tiêu bản
– Xếp tiêu bản vào hộp tránh ánh sáng.
Hình ảnh mô tả các bước nhuộm huỳnh quang bằng hóa chất tự pha (phụ lục 16).
7. ĐỌC TIÊU BẢN, GHI CHÉP VÀ BÁO CÁO KẾT QUẢ
7.1. Lấy vi trường
– Bật nguồn điện.
– Lựa chọn ánh sáng huỳnh quang (gạt nút ngược chiều kim đồng hồ phía ”fluorescence”).
– Chỉnh nút on/of điều chỉnh ánh sáng huỳnh quang.
– Xoay vật kính x10 vào trục quang học.
– Đặt tiêu bản lên mâm kính, sử dụng vật kính x10 để lấy vi trường.
– Điều chỉnh khoảng cách giữa 2 ống thị kính để có 1 hình ảnh trùng nhau.
– Xoay vật kính x 20 vào trục quang học.
– Chỉnh vi cấp để có hình ảnh rõ nét.
7.2. Cách soi tiêu bản và nhận định kết quả
– Cách soi: cần phải hệ thống và chuẩn hóa, soi dòng giữa từ trái sang phải (tương đương với 30 vi trường). Điều chỉnh ốc vi cấp cho hình ảnh rõ nét nhất, quan sát kỹ từ ngoại vi vào trung tâm vi trường để phát hiện AFB. Đọc xong vi trường thứ nhất, chuyển sang đọc các vi trường kế tiếp cho đến hết dòng.
Khi cần đọc > 1 dòng, chuyển dòng sau đó từ phải qua trái .
– Hình thể AFB trên tiêu bản nhuộm huỳnh quang: AFB dạng trực khuẩn mảnh, màu vàng phát quang trên nền tối, AFB đứng riêng rẽ hoặc thành từng đám. Chú ý: một số thành phần khác có thể bắt màu vàng phát quang hoặc không nhưng hình thể không điển hình.
Lưu ý : khi cần xác lập rõ hình ảnh AFB, chuyển vật kính 40, sau đó lại chuyển về vật kính 20 để liên tục nhận định và đánh giá tác dụng .
– Phân loại kết quả như bảng 2.
Hình ảnh AFB trên tiêu bản nhuộm huỳnh quang

Bảng 2: Quy định ghi kết quả xét nghiệm AFB nhuộm huỳnh quang
|
Số lượng AFB quan sát bằng vật kính 20 X |
Kết quả |
Kết quả |
| 0 AFB / 1 dòng | Âm tính | Âm tính |
| 1-29 AFB / 1 dòng | Dương tính | Ghi số lượng AFB đơn cử |
| 30-299 AFB / 1 dòng | Dương tính | 1 + |
|
10-100 AFB / 1 VT ( soi tối thiểu 10 VT ) |
Dương tính | 2 + |
|
> 100 AFB / 1 VT ( soi tối thiểu 4 VT ) |
Dương tính | 3 + |
Ghi chú : 1 dòng tương tự 30 vi trường, VT : vi trường
Bảng 3: So sánh ghi kết quả xét nghiệm AFB 2 phương pháp nhuộm
|
Kết quả |
Nhuộm ZN (phóng đại 1000 lần) 1 dòng = 2cm = 100VT |
Nhuộm huỳnh quang (phóng đại 200 lần) 1 dòng = 2cm = 20VT |
Nhuộm huỳnh quang (phóng đại 400 lần) 1 dòng = 2cm = 40VT |
| Âm tính | 0 AFB / 100 VT | 0 AFB / 20 VT | 0 AFB / tối thiểu 40 VT |
| Ghi số lượng AFB đơn cử | 1 – 9 AFB / 100 VT | 1-29 AFB / 20 VT | 1-19 AFB / 40 VT |
| 1 + | 10 – 99 AFB / 100 VT | 30-299 AFB / 20 VT |
20-199 AFB / 40 VT ( Soi tối thiểu 40 VT ) |
| 2 + |
1 – 10 AFB / 1 VT ( soi tối thiểu 50 VT ) |
10-100 AFB / 1 VT ( soi tối thiểu 10 VT ) |
5-50 AFB / 1 VT ( Soi tối thiểu 20 VT ) |
| 3 + |
> 10 AFB / 1 VT ( soi tối thiểu 20 VT ) |
> 100 AFB / 1 VT ( soi tối thiểu 4 VT ) |
> 50 AFB / 1 VT ( Soi tối thiểu 8 VT ) |
7.3. Ghi chép và báo cáo kết quả
– Kiểm tra số XN trên tiêu bản trùng với số ghi trên phiếu XN.
– Ghi kết quả soi kính vào phiếu XN và sổ xét nghiệm.
– Ghi ngày tháng làm XN và ký tên vào phiếu và sổ xét nghiệm.
– Kết quả dương tính phải ghi bằng mực đỏ trong sổ xét nghiệm.
– Kết quả xét nghiệm được trả ngay sau khi đọc kết quả.
7.4. Lưu trữ tiêu bản
– Không ghi kết quả soi trên tiêu bản.
– Xếp các tiêu bản vào hộp đựng tiêu bản theo thứ tự trong sổ xét nghiệm để phục vụ cho công tác kiểm định tiêu bản.
– Hộp tiêu bản lưu ở nơi thoáng, khô ráo và tránh ánh nắng trực tiếp.
8. KIỂM TRA CHẤT LƯỢNG
8.1. Kiểm tra chất lượng thuốc nhuộm
– Kiểm tra chất lượng thuốc nhuộm ngay sau khi pha lô mới:
+ Chuẩn bị sẵn lô tiêu bản từ mẫu đờm biết trước hiệu quả âm tính và dương thế ở mức độ 1 + .
+ Mỗi lô thuốc nhuộm mới pha nhuộm 3 tiêu bản dương và 3 tiêu bản âm đúng quy trình tiến độ kĩ thuật .
+ Kết quả thuốc nhuộm đạt chất lượng : tiêu bản dương thấy AFB bắt màu vàng phát quang trên nền tối, không thấy cặn thuốc nhuộm, tiêu bản âm không thấy AFB .
+ Kết quả thuốc nhuộm không đạt chất lượng : tiêu bản dương không thấy AFB hoặc AFB bắt màu vàng nhạt không phát quang hoặc phát quang yếu, nền không tối, có nhiều thành phần khác phát quang, thấy cặn thuốc nhuộm, tiêu bản âm thấy AFB .
– Kiểm tra chất lượng thuốc nhuộm hàng tuần: nhuộm chứng dương và âm cùng mẻ, nhuộm tiêu bản thông thường. Đọc kết quả chứng dương và chứng âm trước khi đọc tiêu bản của người bệnh.
– Khi kết quả kiểm tra không đạt, phải xem xét lại toàn bộ quá trình từ thuốc nhuộm, tiêu bản kiểm tra đến kỹ thuật nhuộm soi, nhuộm thêm lô tiêu bản chứng mới nếu kết quả vẫn không đạt phải hủy bỏ thuốc nhuộm.
– Chỉ sử dụng và cấp phát thuốc nhuộm đã kiểm tra đảm bảo chất lượng.
– Phải có sổ pha, kiểm tra, quản lý và cấp phát thuốc nhuộm.
– Hạn sử dụng thuốc nhuộm 1 tháng.
– Chai lọ đựng thuốc nhuộm phải được dán nhãn và hạn sử dụng, được bảo quản nơi thoáng mát, khô ráo và tránh ánh nắng mặt trời.
8.2. Kiểm tra chất lượng tiêu bản
8.2.1. Tiêu chuẩn đánh giá (3 tiêu chuẩn)
8.2.1. 1. Kích thước tiêu bản
Xem mục 9.2.2. Kích thước tiêu bản ( Bài Xét nghiệm AFB nhuộm soi trực tiếp bằng giải pháp nhuộm Ziehl – Neelsen ) .
8.2.1. 2 Độ mịn
Xem mục 9.2.3. Độ mịn ( Bài Xét nghiệm AFB nhuộm soi trực tiếp bằng giải pháp nhuộm Ziehl – Neelsen ) .
8.2.1. 3 Độ dày
Xem mục 9.2.4. Độ dày ( Bài Xét nghiệm AFB nhuộm soi trực tiếp bằng chiêu thức nhuộm Ziehl – Neelsen ) .
8.2.2. Phương pháp đánh giá
– Thực hiện kiểm định tiêu bản theo phương pháp kiểm định theo lô (LQAS).
– Đánh giá chất lượng tiêu bản nhuộm theo 3 tiêu chuẩn: kích cỡ, độ dày và độ mịn.
8.3. Nguyên nhân sai kết quả dương
8.3.1. Nguyên nhân sai dương
– Chất lượng thuốc nhuộm không đạt (nước cất pha auramine nhiễm AFB).
– Kỹ thuật nhuộm chưa đúng: các tiêu bản để quá sít, xối nước mạnh AFB từ tiêu bản dương tràn sang tiêu bản khác, tẩy màu chưa đủ..).
– Nhận định sai AFB do XNV thiếu kinh nghiệm nhầm lẫn với các chất phát quang khác (thức ăn, cặn Auramine..).
– Chất lượng kính kém hoặc điều chỉnh chưa đúng.
8.3.2. Nguyên nhân sai âm
– Chất lượng bệnh phẩm không đạt (không chọn được mảnh đờm để dàn tiêu bản).
– Chất lượng thuốc nhuộm không đạt (nồng độ auramine < 0,1%, nồng độ acid cồn quá 0,5%).
– Kỹ thuật nhuộm chưa đúng: tẩy màu quá, thời gian nhuộm auramine không đủ, nhuộm nền quá lâu.
– Cố định tiêu bản quá nóng.
– Đọc tiêu bản chưa đủ một dòng.
– Thời gian từ khi nhuộm và đọc quá lâu (tiêu bản không giữ trong hộp tối).
8.4. Bảo quản kính hiển vi
– Đặt KHV ở nơi vững chắc, khô ráo, không có bụi, tránh ánh nắng trực tiếp. Độ ẩm cao có thể làm mốc bộ phận quang học (vật kính, thị kính, tụ quang..) và bộ phận cơ học bị han rỉ.
– Tránh va chạm mạnh làm hỏng kính hiển vi.
– Chỉ sử dụng ốc vi cấp khi cần chỉnh rõ nét hình ảnh.
– Lau bộ phận quang học bằng giấy lau chuyên dụng.
– Vệ sinh kính sau mỗi ngày sử dụng.
– Khi không sử dụng để kính ở trạng thái “nghỉ”: tắt nguồn điện, xoay vật kính ra khỏi vị trí quan sát, nâng mâm kính hết cỡ và phủ kính tránh bụi.
– Nếu có điều kiện bảo quản KHV trong tủ bảo quản kính chuyên dụng.
– Nếu phát hiện kính bị hỏng tuyệt đối không được tự ý tháo ra sửa chữa phải báo người có trách nhiệm giải quyết.
9. THỰC HÀNH AN TOÀN PXN (GIỐNG PHƯƠNG PHÁP NHUỘM ZN)
Xem mục 9. Thực hành bảo đảm an toàn của bài xét nghiệm AFB nhuộm soi trực tiếp giải pháp nhuộm ZIEHL – NEELSEN .
X-QUANG TRONG CHẨN ĐOÁN LAO PHỔI
1. VAI TRÒ CỦA XQUANG TRONG CHẨN ĐOÁN LAO PHỔI
– X-quang phổi có độ nhạy cao, vì vậy cần được sử dụng rộng rãi để sàng lọc lao phổi. Tất cả người bệnh có triệu chứng hô hấp (ho, khạc đờm, khó thở…) với bất kỳ thời gian nào đều nên được chụp X-quang ngực sàng lọc lao phổi, đặc biệt ở người có nguy cơ cao như đái đường, người già, suy dinh dưỡng, nhiễm HIV, …
– Tuy nhiên, độ đặc hiệu trên phim chụp X-quang không cao, vì vậy không nên chẩn đoán xác định lao phổi chỉ dựa vào phim X-quang đơn thuần.
– Sự thay đổi đặc điểm tổn thương theo thời gian và đáp ứng điều trị sẽ mang lại ý nghĩa tốt hơn cho chẩn đoán, vì vậy cần chụp X-quang ở nhiều thời điểm hoặc đối chiếu với phim chụp trước đây.
– Các hình ảnh tổn thương trên phim X-quang của lao phổi không chỉ gặp riêng trong lao mà còn gặp trong nhiều bệnh lý khác (tính đặc hiệu không cao).
– Mọi hình thái và đặc điểm tổn thương không phải lúc nào cũng gặp đầy đủ trên một bệnh nhân. Nên càng nhiều yếu tố gợi ý càng có giá trị hướng tới lao phổi.
– X-quang phổi sàng lọc sau đó xác định vi khuẩn bằng Xpert là chiến lược “HAI X” của Chương trình chống lao Quốc gia Việt Nam.
2. CÁC KỸ THUẬT X-QUANG TRONG CHẨN ĐOÁN
– Để phát hiện và chẩn đoán lao phổi có nhiều kỹ thuật X-quang, nhưng phổ biến nhất là chụp phổi thẳng thường quy (tư thế sau – trước), chụp phổi nghiêng thường quy và chụp đỉnh phổi tư thế ưỡn ngực ( tư thế Lordotic).
– Với những trường hợp khó chẩn đoán bằng các kỹ thuật X-quang thường quy, người ta tiến hành chụp cắt lớp vi tính (CT). Một số kỹ thuật X-quang khác cũng được sử dụng để chẩn đoán phân biệt: dựng hình phế quản (soi phế quả ảo), chụp động mạch phổi, chiếu phổi trên truyền hình tăng sáng, …
– Trong hoạt động điều tra lao phổi trong cộng đồng: người ta đã sử dụng các xe X- quang huỳnh quang lưu động: MMR (Mass Miniature Radiography-Photofluography) hoặc xe Xquang kỹ thuật số (Digital MobileX-ray Car).
3. QUY TRÌNH KỸ THUẬT CHỤP X-QUANG NGỰC THƯỜNG QUY
– Quy trình chụp phổi thẳng (xem phụ lục 11).
– Quy trình chụp phổi nghiêng (xem phụ lục 12).
– Quy trình chụp phổi tư thế đỉnh phổi ưỡn (tư thế Lordotique) (xem phụ lục 13).
4. MÔ TẢ VÀ PHÂN TÍCH HÌNH ẢNH XQUANG CỦA LAO PHỔI TRÊN PHIM PHỔI THƯỜNG QUY
4.1. Hình ảnh tổn thương
4.1.1. Nốt: là một bóng mờ có kích thước nhỏ, đường kính nốt kê ≤ 2mm (lao kê), 2mm < đường kính nốt nhỏ ≤ 5mm, 5mm < đường kính nốt to < 10mm. Đậm độ của nốt rất thay đổi: có thể độ tương phản rất ít so với mô phổi xung quanh hoặc gần bằng đậm độ của mạch máu, có khi đậm độ cao gần bằng đậm độ xương hoặc kim loại. Tập hợp của các nốt gọi là đám mờ.
4.1.2. Thâm nhiễm: là đám mờ đồng đều có đặc điểm:
– Có hình “phế quản hơi’’.
– Không đẩy hoặc co kéo các tổ chức lân cận.
– Có thể mờ theo định khu: thùy/phân thùy hoặc mờ rải rác.
4.1.3. Hang: là hình sáng giới hạn bởi một bờ mở tròn khép kín liên tục, đường kính ≥ 0,5cm. Độ sáng của hang cao hơn của nhu mô phổi, kích thước của hang đa dạng: trung bình từ 2 – 4cm, 4cm ≤ hang lớn < 6cm, hang khổng lồ ≥ 6cm, tuy nhiên có thể rất lớn chiếm 1/2 phế trường, 1 thùy phổi.. hoặc rất nhỏ và tập trung lại tạo hình “rỗ tổ ong” hoặc “ruột bánh mì”.
Thành hang : có độ dày ≥ 2 mm phân biệt với những bóng giãn phế nang. Trong lòng hang thường là hình sáng của khí, đôi lúc có mức dịch còn gọi là hình liềm khí .
4.1.4. Dải xơ mờ: là các đường mờ có đường kính rộng từ 0,5 – 1 mm, thường tạo giống “hình lưới” hoặc hình “vân đá”.
4.1.5. Nốt vôi hóa: đâm độ gần tương đương kim loại và chất cản quang, hoặc đậm hơn xương, là những nốt có đậm độ cao, ranh giới rõ, thường gặp ở những trường hợp lao ổn định hoặc lao cũ …
4.1.6. Bóng mờ (u lao): Hình tròn hoặc hình ovan đậm độ đồng đều, bờ rõ, có thể đơn độc hoặc phối hợp với các dạng tổn thương khác của lao phổi. Cần phân biệt về kích thước, ranh giới của bóng mờ, có nốt vôi hóa không? (nếu có thì đồng tâm hay lệch tâm).
4.1.7. Bóng mờ giả định là hạch (thường gặp trong lao sơ nhiễm): các nhóm hạch thường gặp: nhóm cạnh khí quản, nhóm khí phế quản, nhóm rốn phổi, nhóm dưới chỗ phân chia phế quản gốc phải và phế quản gốc trái (Subcarina).
4.1.8. Hình ảnh tràn dịch màng phổi
– Mờ đồng đều không theo định khu thùy, phân thùy: Góc giữa ranh giới trên của hình mờ với thành ngực là góc tù.
– Có xu hướng đẩy các cơ quan – bộ phận lân cận sang bên đối diện, làm rộng các khoang liên sườn: nếu là tràn dịch màng phổi tự do.
– Có xu hướng co kéo các cơ quan bộ phận lân cận về bên tổn thương, kéo hẹp các khoang liên sườn: nếu là dày dính màng phổi hoặc vôi hóa màng phổi.
4.1.9. Hình ảnh tràn khí màng phổi
– Có hình dải sáng dọc theo màng phổi ở bên bị tràn khí, rất rõ ở vùng đỉnh.
– Thấy hình màng phổi tạng dưới dạng một dải viền, bao lấy nhu mô phổi bị co lại.
– Không thấy hình mạch phổi ngoài giới hạn của màng phổi tạng.
Xem phụ lục 14: Hình ảnh của các hình thái tổn thương lao
4.2. Tổng hợp hình ảnh Xquang lao phổi
a. Thường thấy ở vùng cao của phổi : vùng đỉnh – hạ đòn, cạnh rốn phổi ( tương ứng với những phân thùy 1, 2, 3 và 6 ) .
b. Mức độ nặng hoàn toàn có thể lan ra hết một phổi hoặc cả hai bên phổi .
c. Tổn thương hai bên hoàn toàn có thể là đối xứng ngang hoặc đối xứng chéo .
d. Tổn thương xen kẽ nhiều hình thái không thay đổi ( xơ vôi ) với những hình thái tiến triển ( thâm nhiễm, nốt, hang … ) .
e. Đáp ứng chậm với thuốc chống lao sau 1 tháng điều trị
f. Tổn thương không đổi khác với điều trị kháng sinh thường thì. Vì vậy, khi tổn thương đổi khác nhanh trong thời hạn dưới 50% tháng phải rất là thận trọng khi chẩn đoán lao phổi .
5. ĐẶC ĐIỂM TỔN THƯƠNG LAO PHỔI Ở NGƯỜI NHIỄM HIV
– Giai đoạn lâm sàng sớm của nhiễm HIV (tế bào CD4 ≥ 200): hình ảnh tổn thương của Lao phổi / HIV(+) nói chung không có sự khác biệt so với hình ảnh lao phổi /HIV( -)
– Giai đoạn AIDS (tế bào CD4 < 200): hình ảnh tổn thương lao không còn điển hình nữa, có một số đặc điểm như:
+ Ít thấy tổn thương hang .
+ Tổn thương vùng cao không còn là thông dụng, sửa chữa thay thế vào đó tổn thương có tính lan tỏa ( diffuse ), thường cả ở vùng thấp của phổi .
+ Hình ảnh tiến triển nhanh hơn, lan tỏa, tổn thương khoảng chừng kẽ nhiều hơn, vì thế ít thấy tổn thương xen kẽ có đủ thanh phần với độ tuổi khác nhau phản ánh quy trình tiến triển chậm như thâm nhiễm, nốt, hang, xơ, vôi hóa .
Source: https://vh2.com.vn
Category : Nghe Nhìn





